Кальциевая сигнализация регулирует ретракцию ламеллиподий в хемотактирующих нейтрофилах человека
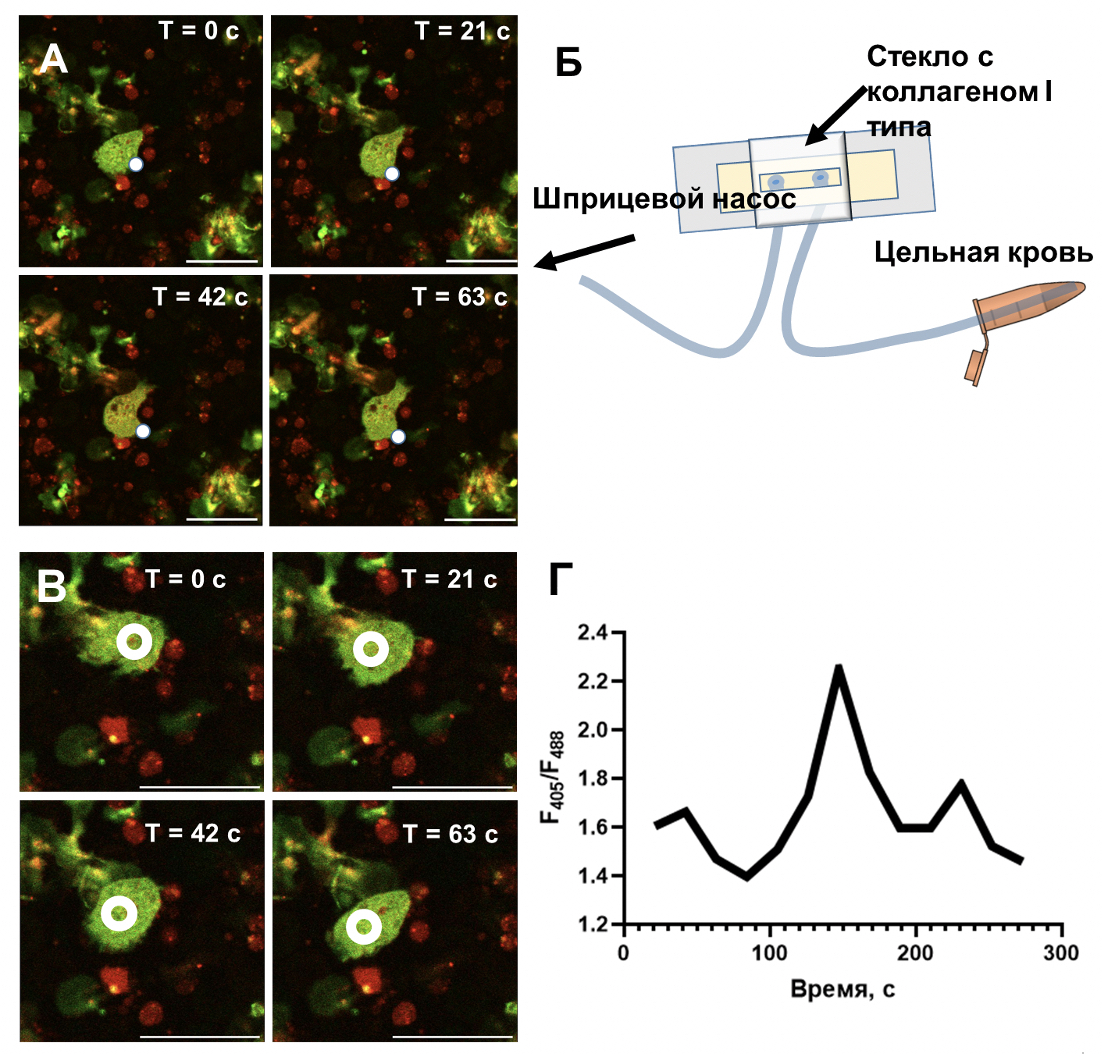
Рисунок 1. Методы наблюдения кальциевой сигнализации в нейтрофилах, движущихся вокруг растущего тромба. (А) Типичное изображение растущей ламеллиподии нейтрофила. Белой точкой показан край растущей ламеллиподии. Шкала 20 мкм. (Б) Схема эксперимента: цельная кровь, окрашенная флуоресцентной меткой Fura RED, прокачивалась через плоско-параллельную проточную камеру в течение 30 минут. (В) Пример области, в котором измерялась флуоресценция Fura RED (белый круг). Шкала 20 мкм. (Г) Типичный вид динамики концентрации кальция (F405/F488) для одиночного нейтрофила.
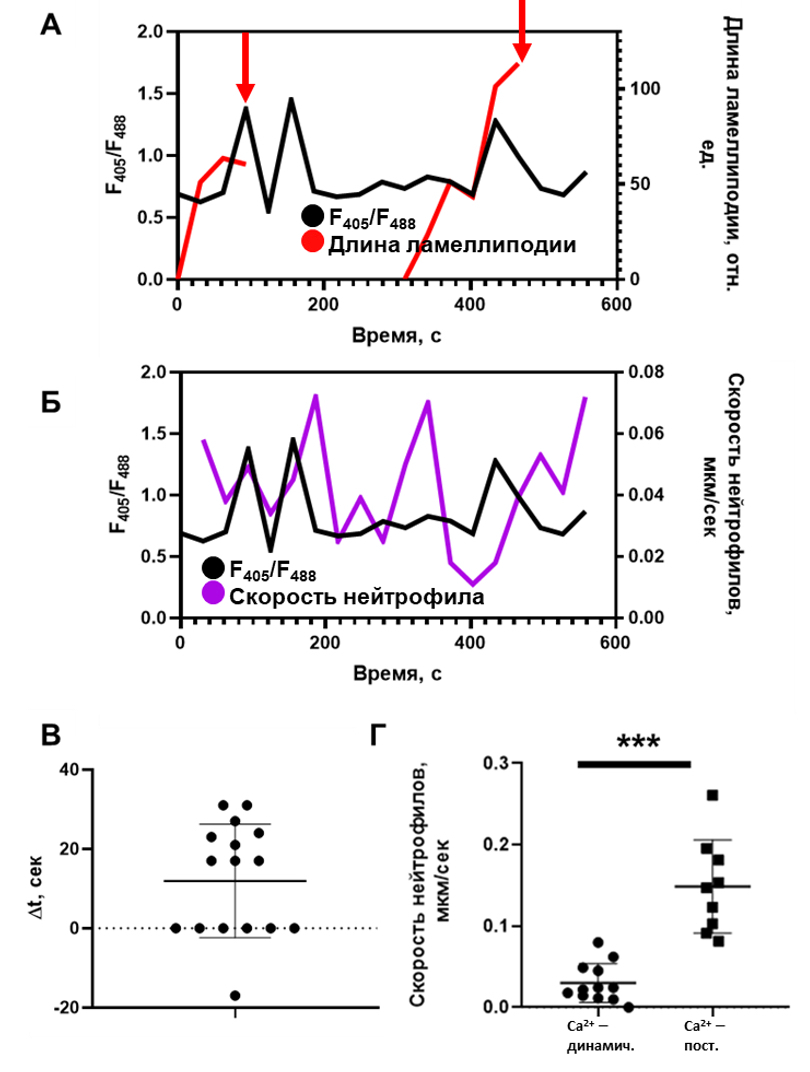
Рисунок 2. Экспериментально наблюдаемый кальциевый ответ в нейтрофилах не влияет на подвижность клеток, но регулирует ретракцию ламеллиподий. А. Типичный кальциевый ответ в движущемся нейтрофиле. Ретракция ламеллиподий (красная стрелка) сопадает по времени с пиком концентрации кальция. На графике представлен типичный ответ из N = 16 событий ретракции ламеллиподий из 12 проанализированных клеток для 3 здоровых доноров. Б. В типичном нейтрофиле кальциевый ответ не коррелирует с подвижностью нейтрофила. На графике представлен типичный ответ из N = 12 проанализированных клеток для 3 здоровых доноров. В. Временная задержка между ретракцией ламеллиподии и ближайшим по времени кальциевым пиком. С помощью критерия Уилкоксона (p = 0,03) показано, что временная задержка не распределена нормально со средним Δt = 0 сек. Г. Скорости нейтрофилов, в которых уровень кальция постоянен, значительно выше, чем в клетках, в которых наблюдается динамический кальциевый ответ.
Проанализировано N = 21 клеток для 3 здоровых доноров. *** - p<0,001. Статистическая значимость рассчитана с помощью теста Манна-Уитни.
Имитация внеклеточного матрикса на основе полимеров для создания модели микроокружения опухоли
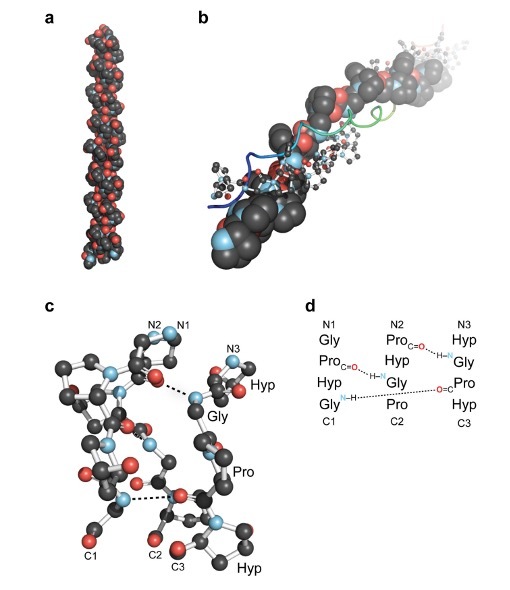
Рисунок 1. Обзор тройной спирали коллагена. (a) Первая кристаллическая структура высокого разрешения тройной спирали коллагена, образованной из (ProHypGly)4-(ProHypAla) (ProHypGly). (b) Вид по оси тройной спирали (ProProGly) с тремя нитями, изображенными в виде заполнения пространства, шара и палочки, а также ленты. (c) Изображение сегмента тройной спирали коллагена в виде шарика и палочки, подчеркивающее лестницу межнитевых водородных связей. (d) Поэтапное расположение трех нитей в сегменте на панели c [9].
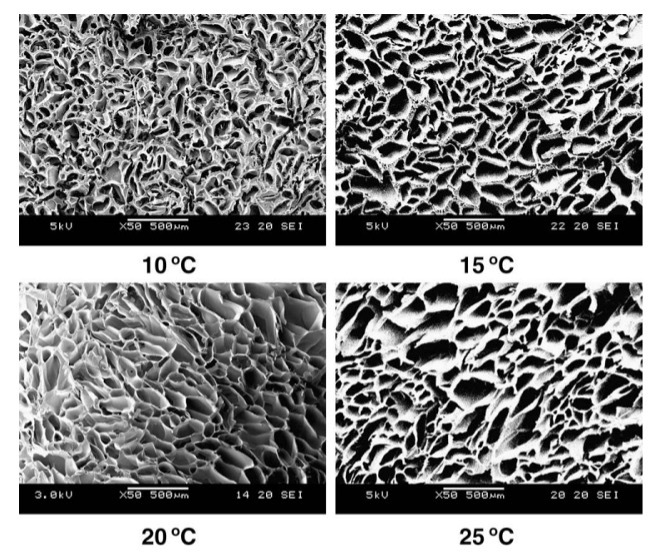
Рисунок 2. SEM-структура скаффолдов, сшитых при разных температурах. Зависимость размера пор от температуры образования: при увеличении температуры полимеризации растер размер пор [32].
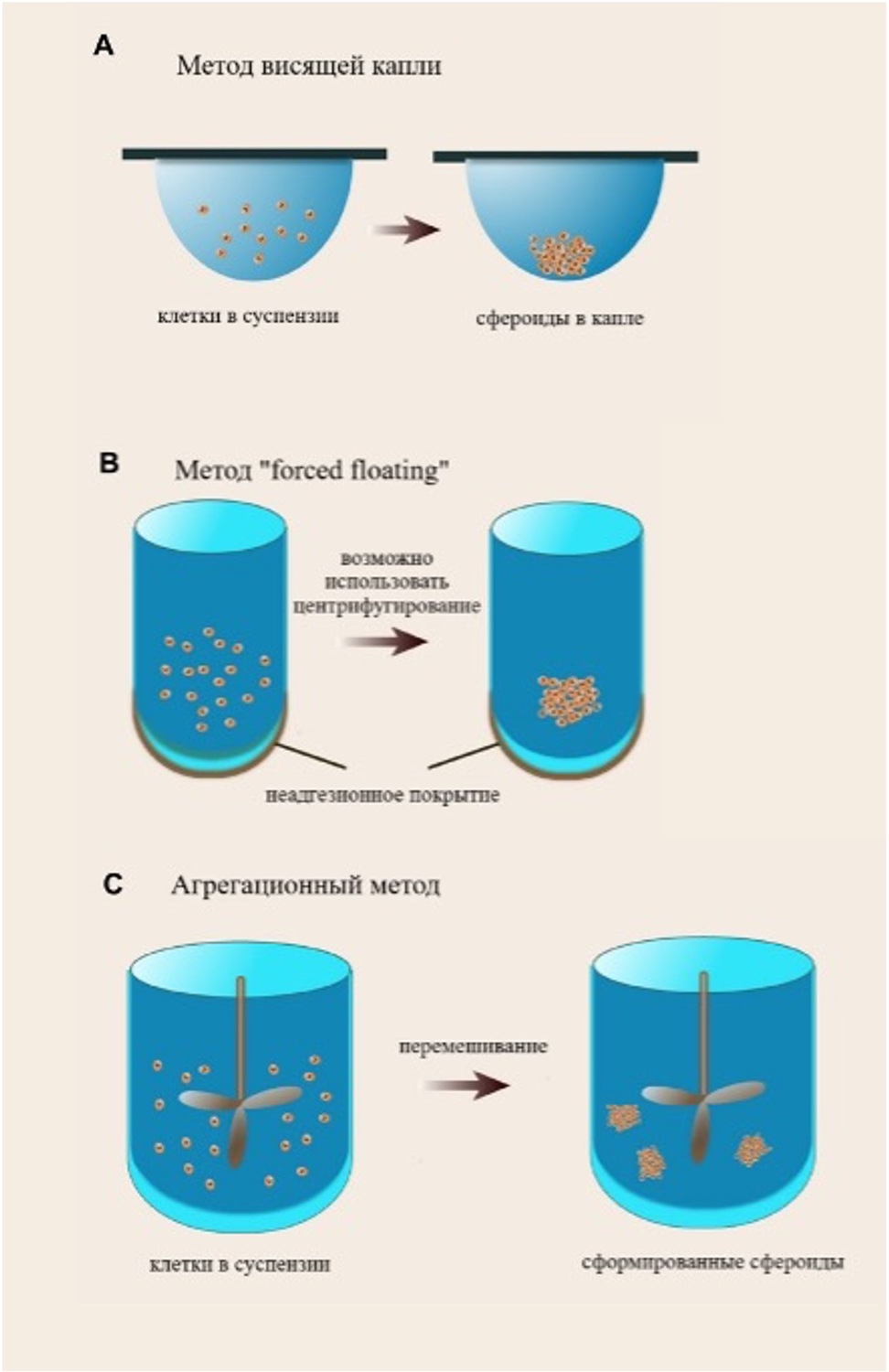
Рисунок 3. Методы формирования клеточных сфероидов [56].
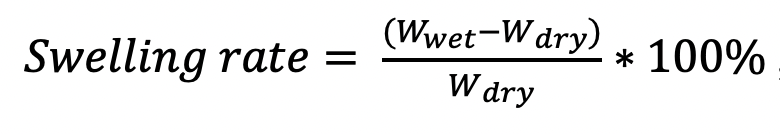
Формула 1.
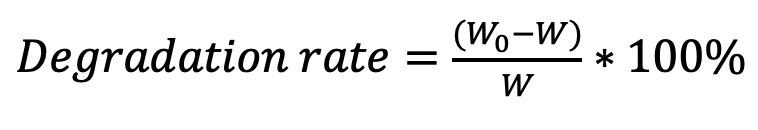
Формула 2.
Взаимодействие протромбина с субпопуляциями активированных тромбоцитов
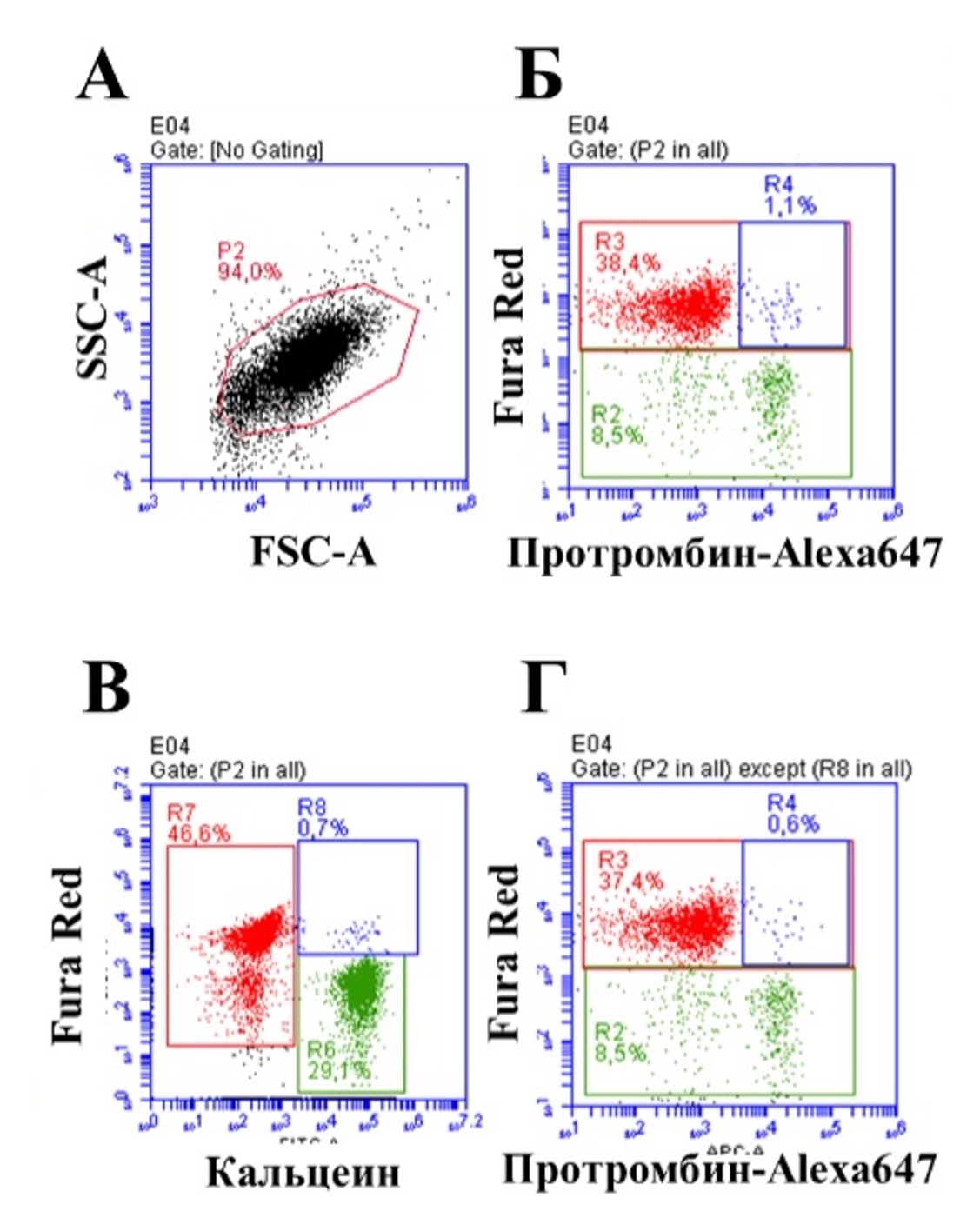
Рисунок 1. Связывание протромбина с субпопуляции активированных тромбоцитов. На рисунке приведены типичные точечные диаграммы. А – выделение региона тромбоцитов по прямому и боковому светорассеянию. Б- связывание протромбина с популяциями активированных тромбоцитов до исключения из рассмотрения агрегатов ФС-положительных и ФС-отрицательных тромбоцитов. Зеленым показана субпопуляция ФС-положительных тромбоцитов, красным -ФС-отрицательных тромбоцитов, синим – события с высоким связыванием протромбина в регионе ФС-отрицательных тромбоцитов. В- выделение агрегатов ФС-положительных и ФС-отрицательных тромбоцитов. Зеленым показаны тромбоциты, окрашенные кальцеином, красным – окрашенные FuraRed, синим – события окрашенные и кальцеином, и FuraRed. Г - связывание протромбина с популяциями активированных тромбоцитов после исключения из рассмотрения агрегатов ФС-положительных и ФС-отрицательных тромбоцитов. Зеленым показана субпопуляция ФС-положительных тромбоцитов, красным -ФС-отрицательных тромбоцитов, синим – события с высоким связыванием протромбина в регионе ФС-отрицательных тромбоцитов. Представлены результаты типичного эксперимента из трех, проведенных с кровью разных доноров.
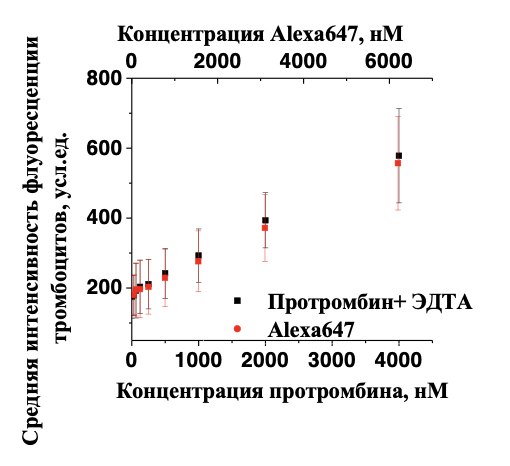
Рисунок 2. Неспецифическое взаимодействие флуорофора с активированными тромбоцитами. Черным цветом показано связывание протромбина-Alexa647 с активированными тромбоцитами в присутствии ЭДТА. Красным показано взаимодействие флуорофора Alexa647 активированными тромбоцитами.
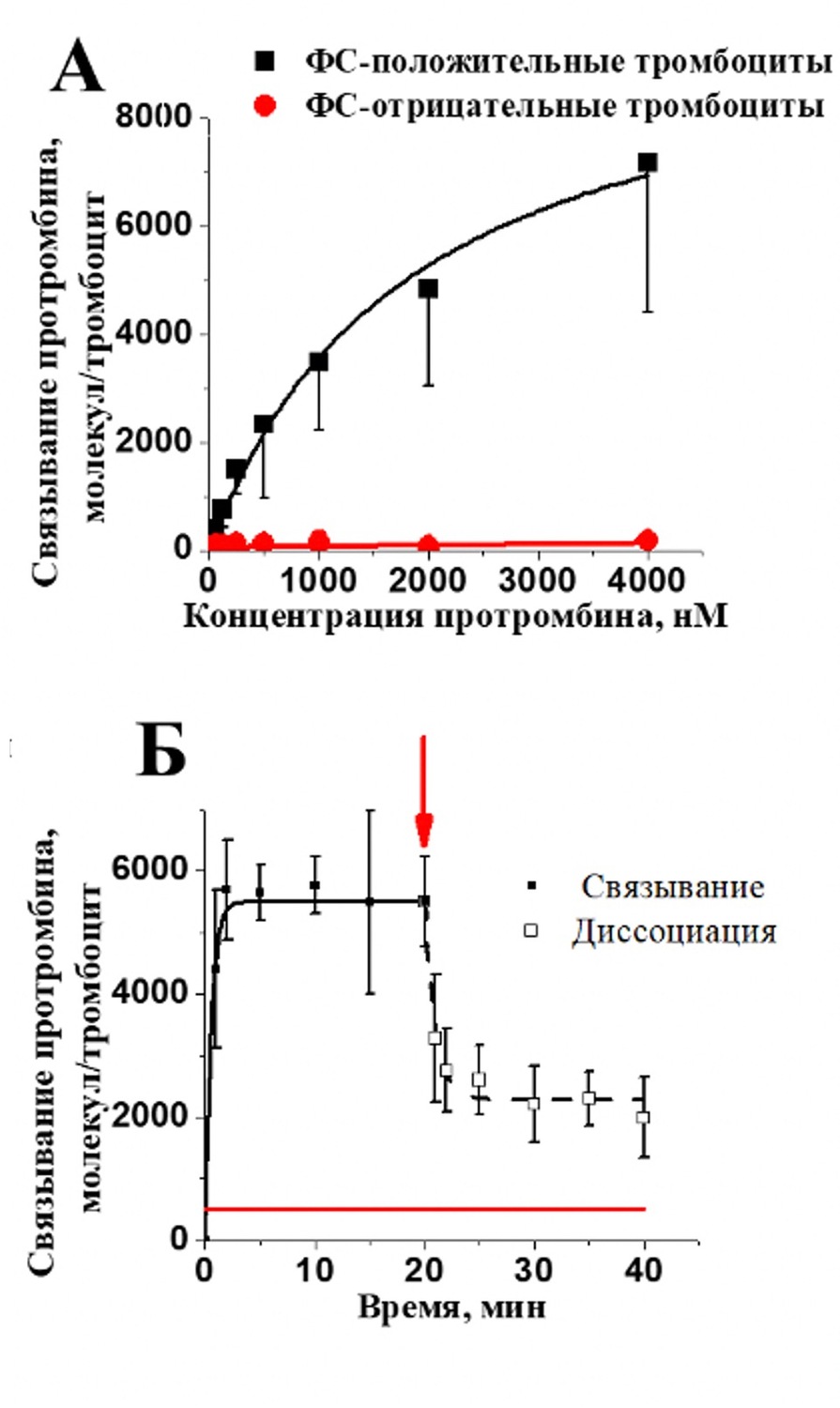
Рисунок 3. Связывание протромбина с субпопуляции активированных тромбоцитов. А – равновесное связывание с ФС-положительными (черная кривая) и ФС-отрицательными (красная кривая) тромбоцитами. Связывание оценивали методом проточной цитометрии. На графике приведены средние±SD (n=3). Б - кинетика связывания и диссоциации протромбина-Alexa647 с фосфатидилсерин положительными тромбоцитами. Связывание протромбина-Alexa647 анализировали с помощью проточного цитометра в моменты времени: 0; 1; 2; 5; 10; 15; 20 минут после добавления белка. После достижения насыщения, образцы разводили в 20 раз буфером Тироде с CaCl2 (2,5 мМ), для анализа диссоциации белка. На графиках приведены средние±SD (n=4).
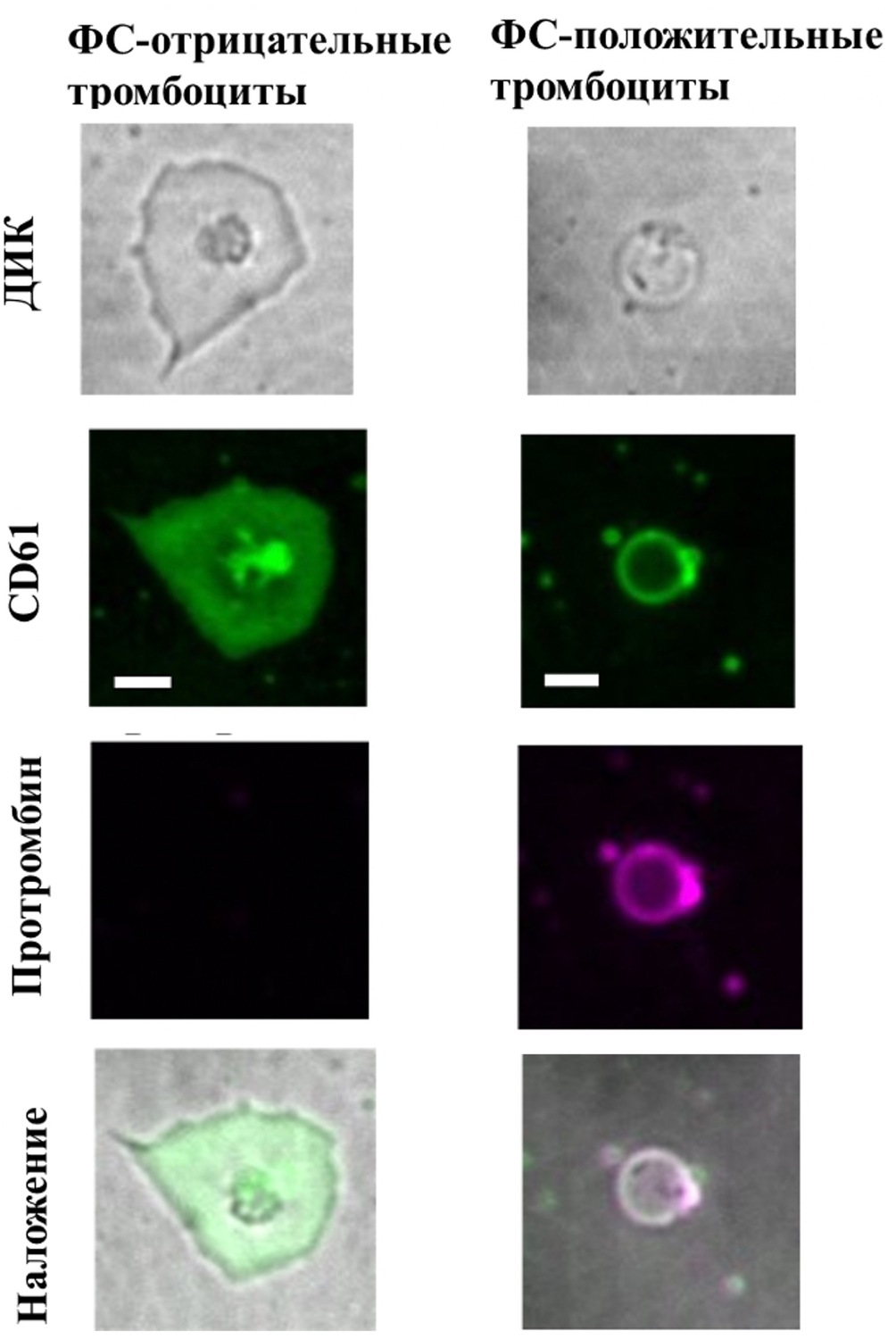
Рисунок 4. Распределение флуоресцентно меченного протромбина на мембране активированных тромбоцитов. Типичные микрофотографии активированных тромбоцитов. Зеленым показана флуоресценция CD61-ФИТЦ, пурпурным - флуоресценция Alexa647-ФII. В первом ряду показаны ФС-отрицательные тромбоциты, во втором ФС-положительные. Приведенный масштаб соответствует 3 мкм.
Характеризация подкожной in vivo модели почечно-клеточного рака Renca у мышей линии BALB/c
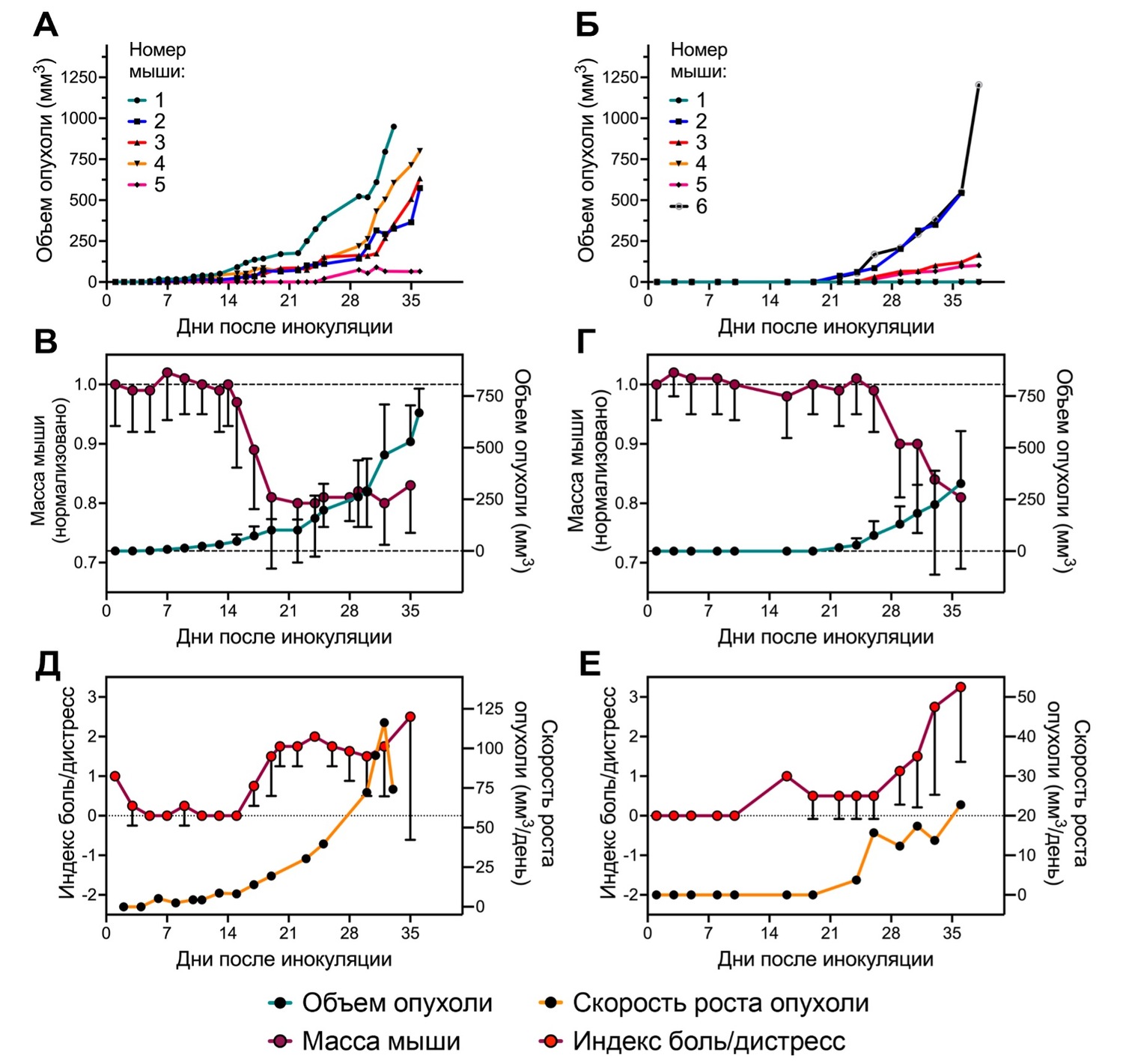
Рисунок 1. Подкожная in vivo модель рака почки Renca у мышей BALB/c. Кинетики роста опухолей у отдельных мышей в эксперименте #1 (А) и #2 (Б); Кинетики усредненного роста опухолей и изменения средней массы мышей в эксперименте #1 (В) и #2 (Г); Кинетики изменения среднего индекса боль/дистресс и средней скорости роста опухолей в эксперименте #1 (Д) и #2 (Е). Средние значения ± SD, для усреднения взяты мыши 1-4 в эксперименте #1 и мыши 2,3,4,6 в эксперименте #2.
Моделирование светорассеяния на одиночном тромбоците и их агрегатах.
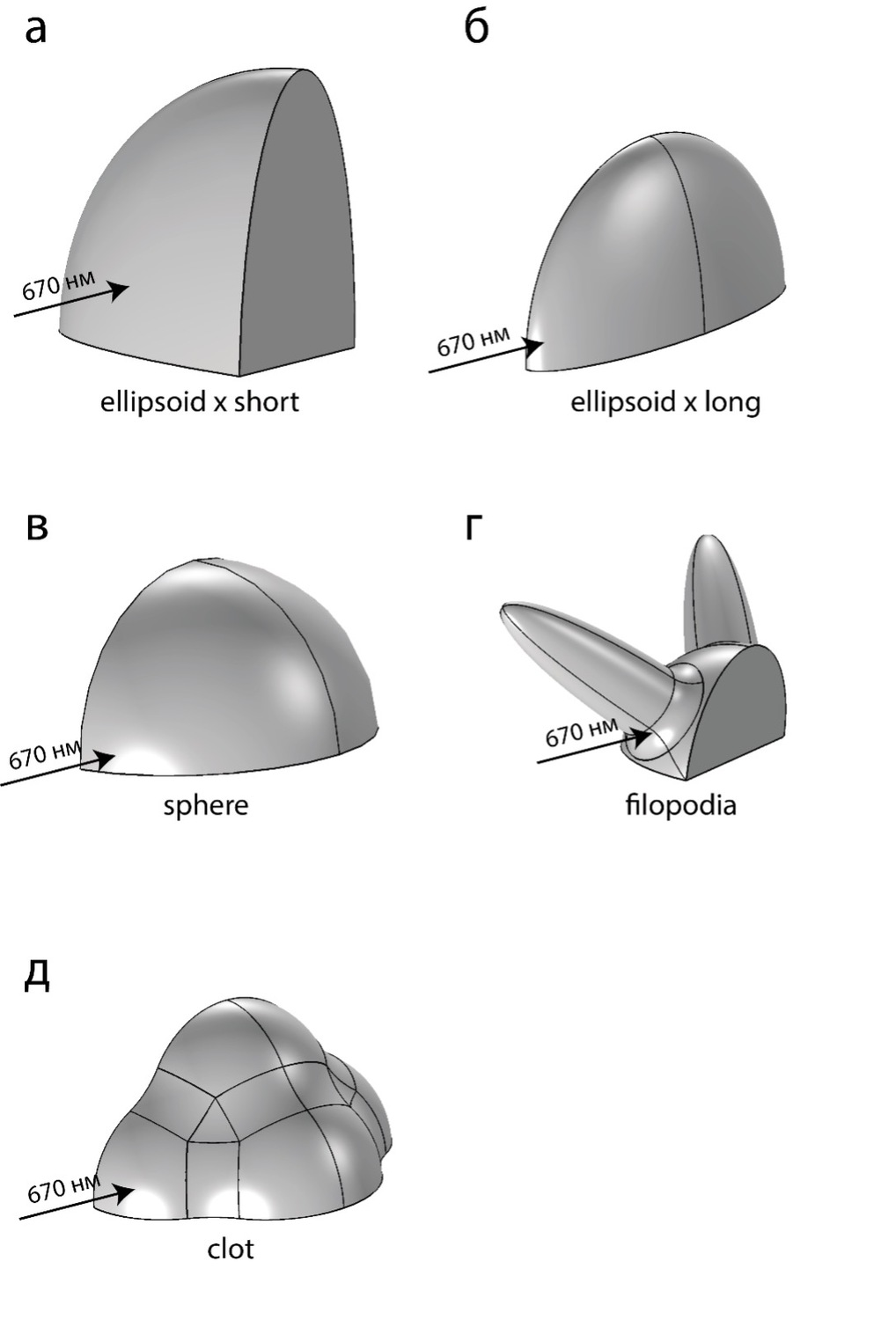
Рисунок 1. Четверти трёхмерных моделей тромбоцита/тромба. (А) ellipsoid x short – тромбоцит находится в состоянии покоя. Луч света от источника параллелен короткой оси тромбоцита. (Б) ellipsoid x long – тромбоцит находится в состоянии покоя. Луч света от источника параллелен длинной оси тромбоцита. Случаи (а) и (б) отличаются только ориентацией объекта в пространстве, клетка повернута на 90 градусов. (В) sphere – тромбоцит начал активацию и стал шаром. (Г) filopodia – тромбоцит, выпустивший филоподии. (Д) clot – агрегат из 6 клеток.
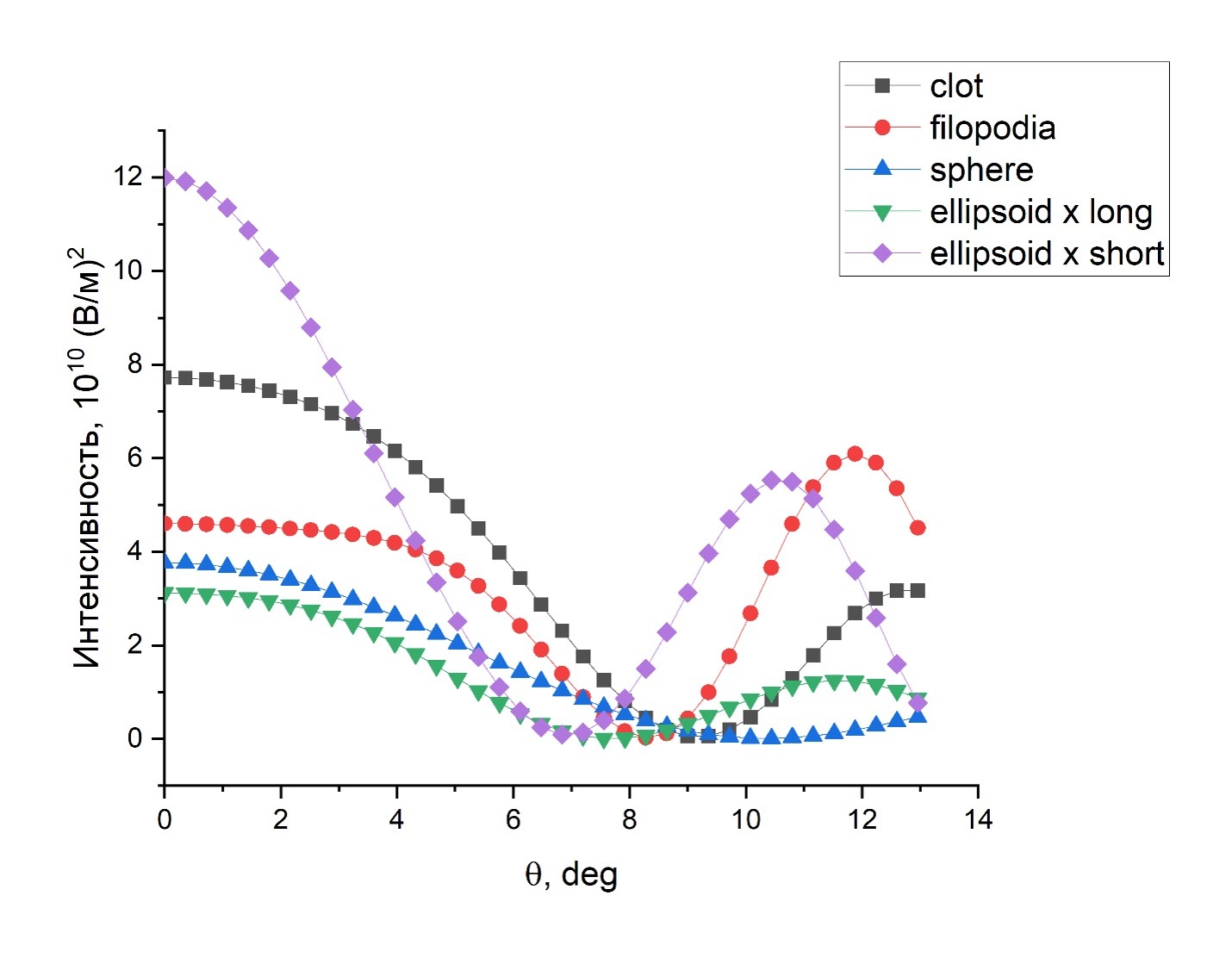
Рисунок 2. Диаграммы направленности дальнего электрического поля при малых углах для агрегата (черная линия, clot), ошаренного тромбоцита (синяя линия, sphere), тромбоцита выпустившего филоподии (красная линия, filopodia), неактивированного тромбоцита в форме эллипсоида, когда луч света направлен параллельно длинной (зеленая линия, ellipsoid x long) или короткой оси (фиолетовая линия, ellipsoid x short)
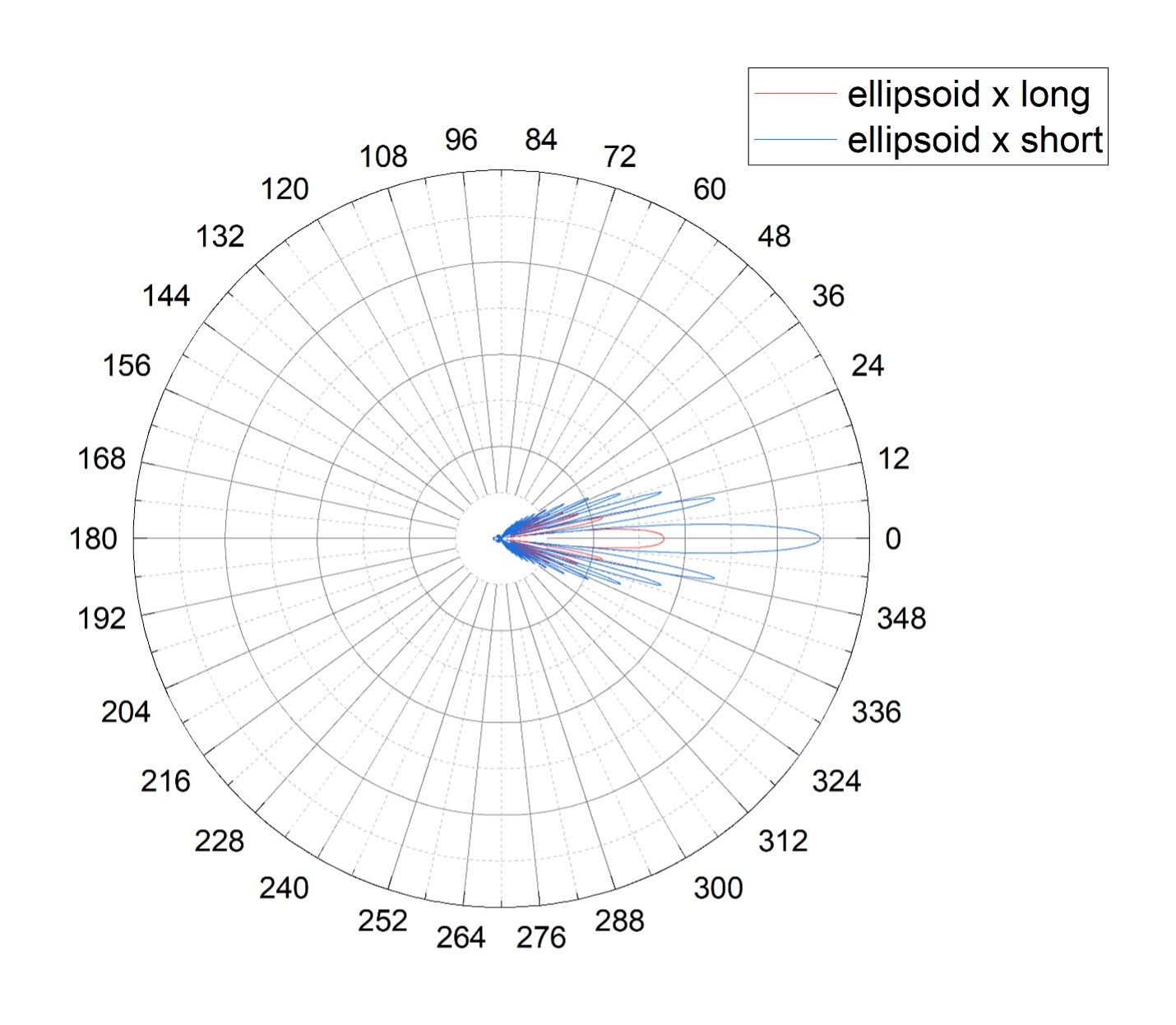
Рисунок 3. Диаграммы направленности для двух ориентаций покоящегося тромбоцита: свет направлен параллельно короткой (синяя линия, ellipsoid x short) или длинной (красная линия, ellipsoid x long) оси эллипсоида.
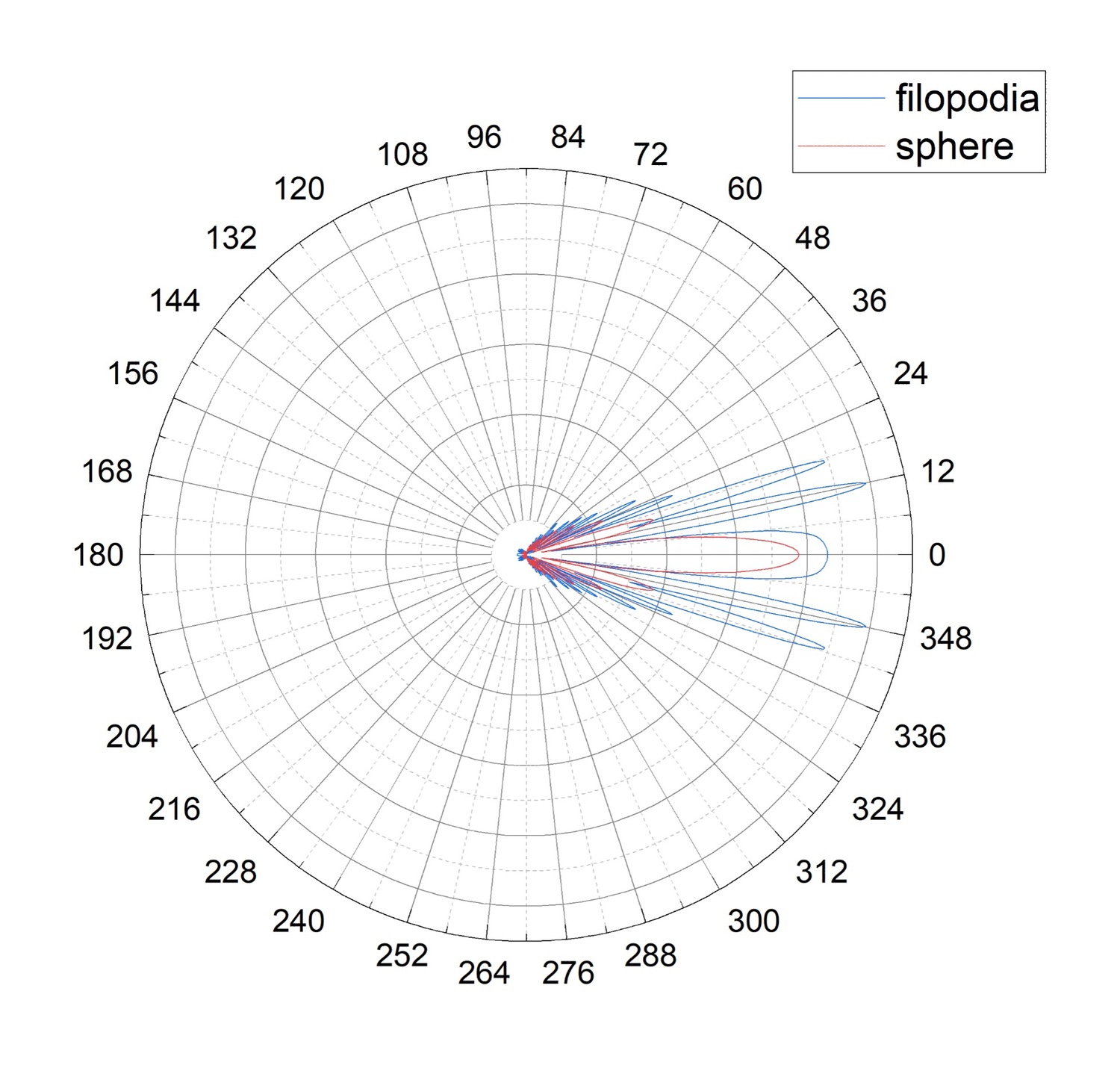
Рисунок 4. Диаграммы направленности для двух активированных состояний тромбоцита: выпустившего филоподии (обозначено синим цветом, filopodia) или ошаренного (обозначенного красным цветом, sphere)
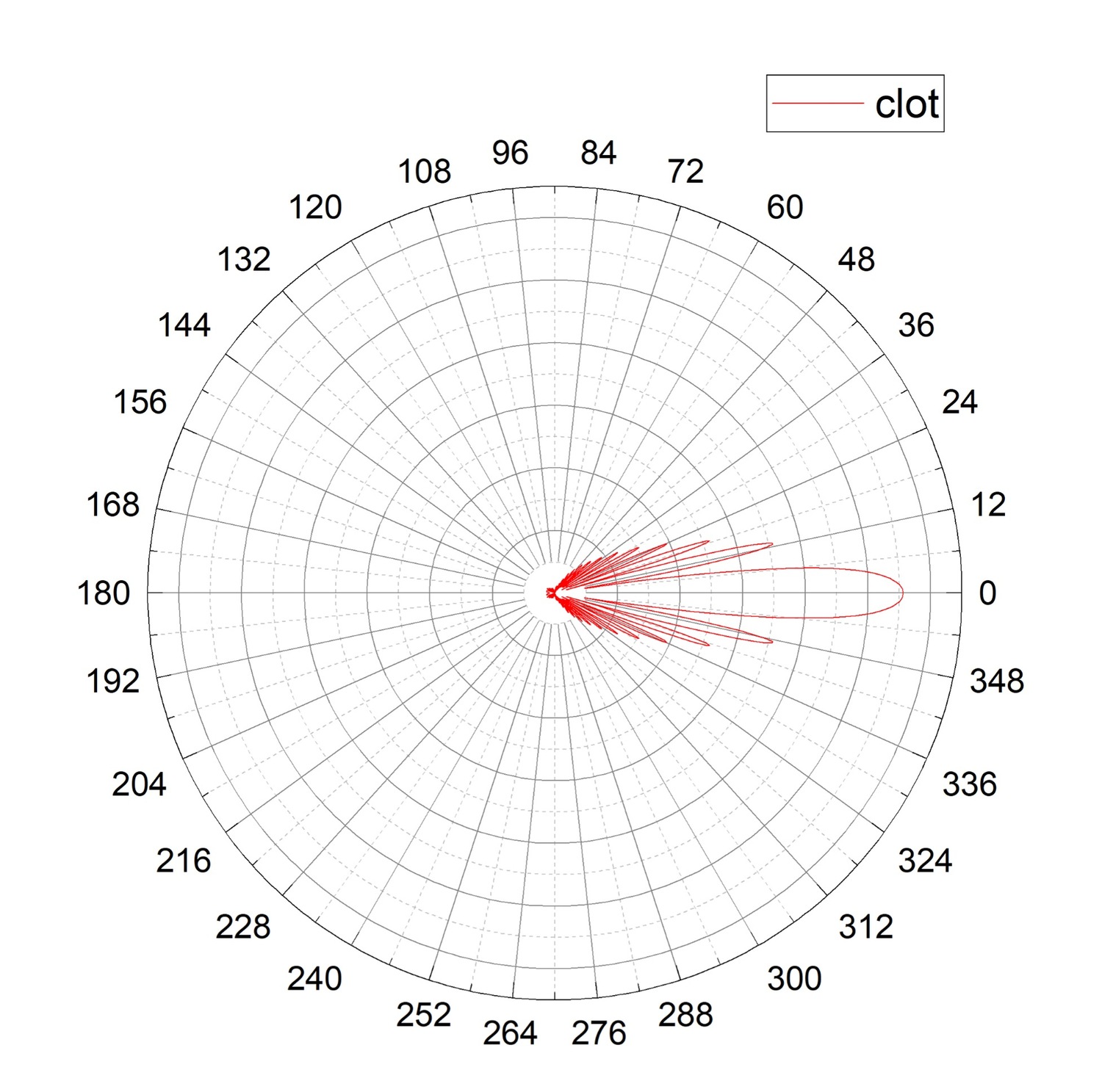
Рисунок 5. Диаграммы направленности для агрегата из тромбоцитов (гексамера, красная линия, clot). Максимальный уровень светорассеяния приходится на 0°
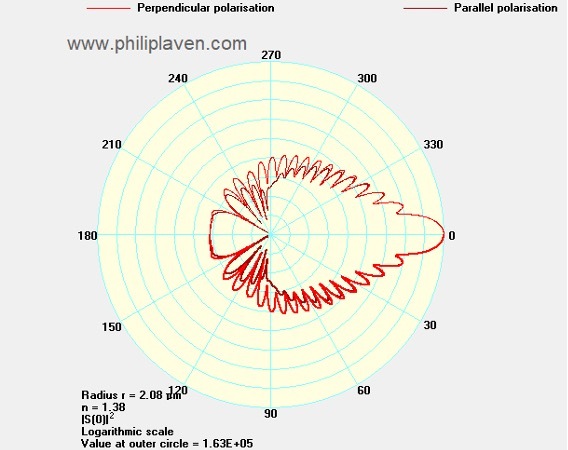
Рисунок 6. Зависимость интенсивности светорассеяния от угла в полярных координатах для перпендикулярно (обозначено красным) и параллельно (обозначено бордовым) поляризованного света. Угловое разрешение - 0.1, радиус сферы 2.08 мкм. Показатель преломления объекта - 1.38. Показатель преломления среды 1.33.
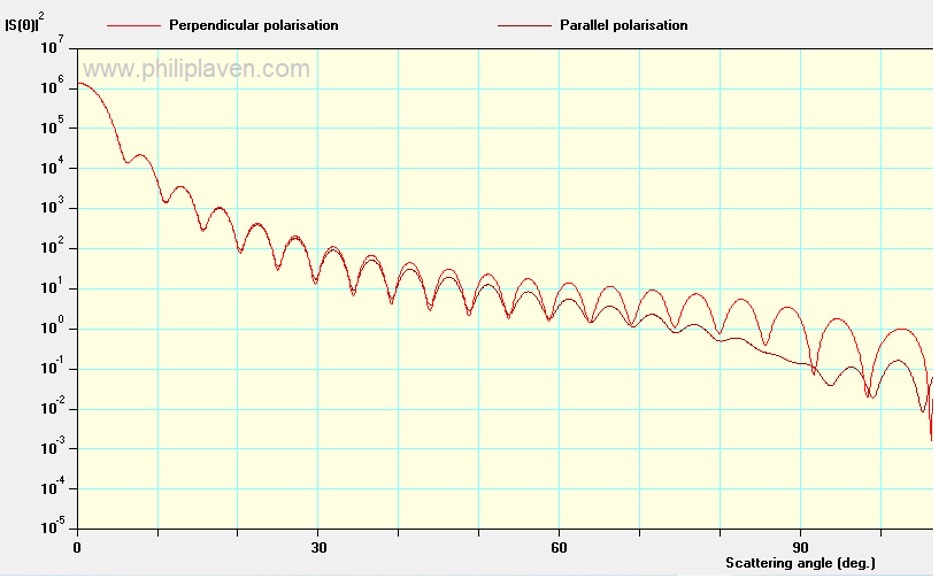
Рисунок 7. Зависимость интенсивности светорассеяния от угла в полярных координатах для перпендикулярно (обозначено красным) и параллельно (обозначено бордовым) поляризованного света. Угловое разрешение - 0.1, радиус сферы 3.12 мкм. Показатель преломления объекта -1.38. Показатель преломления среды 1.33
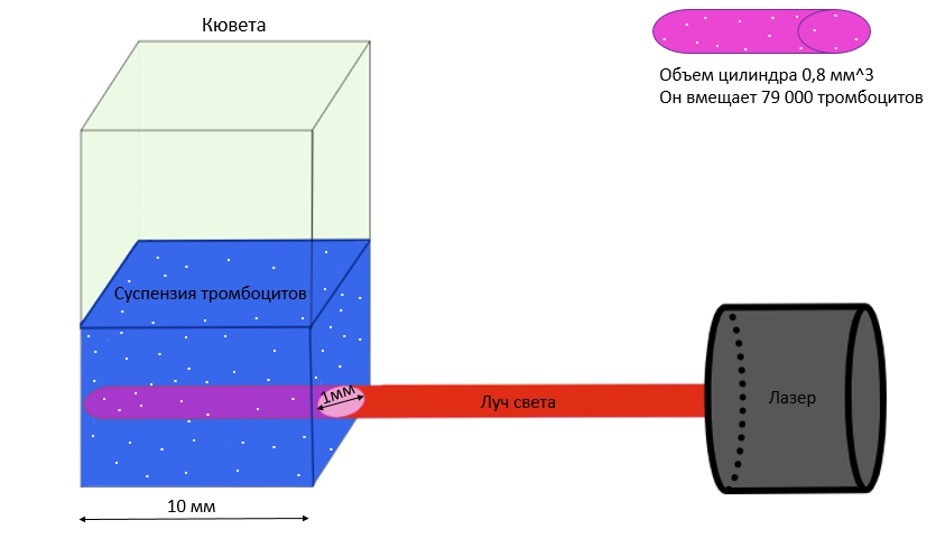
Рисунок 8. Лазер освещает цилиндрический сегмент объемом 0.8 мм3, в котором расположено 79 000 одиночных тромбоцитов.
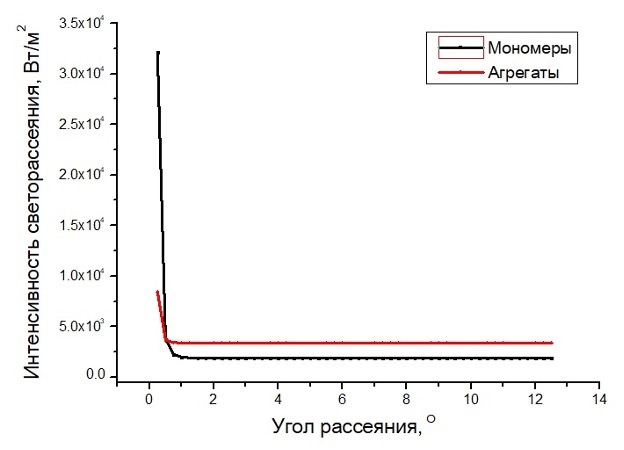
Рисунок 9. Индикатриса рассеяния в среде, содержащей суспензию тромбоцитов (черная кривая) и агрегатов тромбоцитов (красная кривая), рассчитанная аналитически с помощью среды Visual Studio Code v1.85.2 (Microsoft Corporation).

Рисунок 10. Интенсивность светорассеяния на 1° линейно убывает с увеличением концентрации рассеивающих объектов. Черная линия отображает зависимость для тромбоцитов-мономеров, красная – для агрегатов. Индикатриса рассеяния в среде, содержащей суспензию агрегатов тромбоцитов, рассчитана аналитически с помощью среды Visual Studio Code v1.85.2 (Microsoft Corporation).
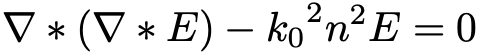
Формула 1.
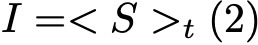
Формула 2.
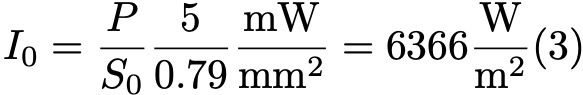
Формула 3.
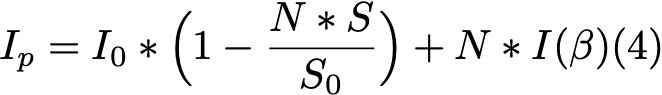
Формула 4.
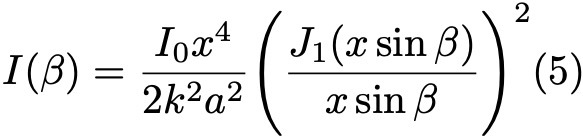
Формула 5.
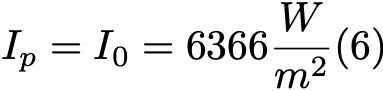
Формула 6.
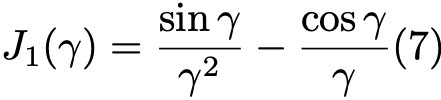
Формула 7.
Определение роли перестройки цитоскелета в процессе кластеризации тромбоцитарных рецепторов к коллагену методами агентного моделирования.
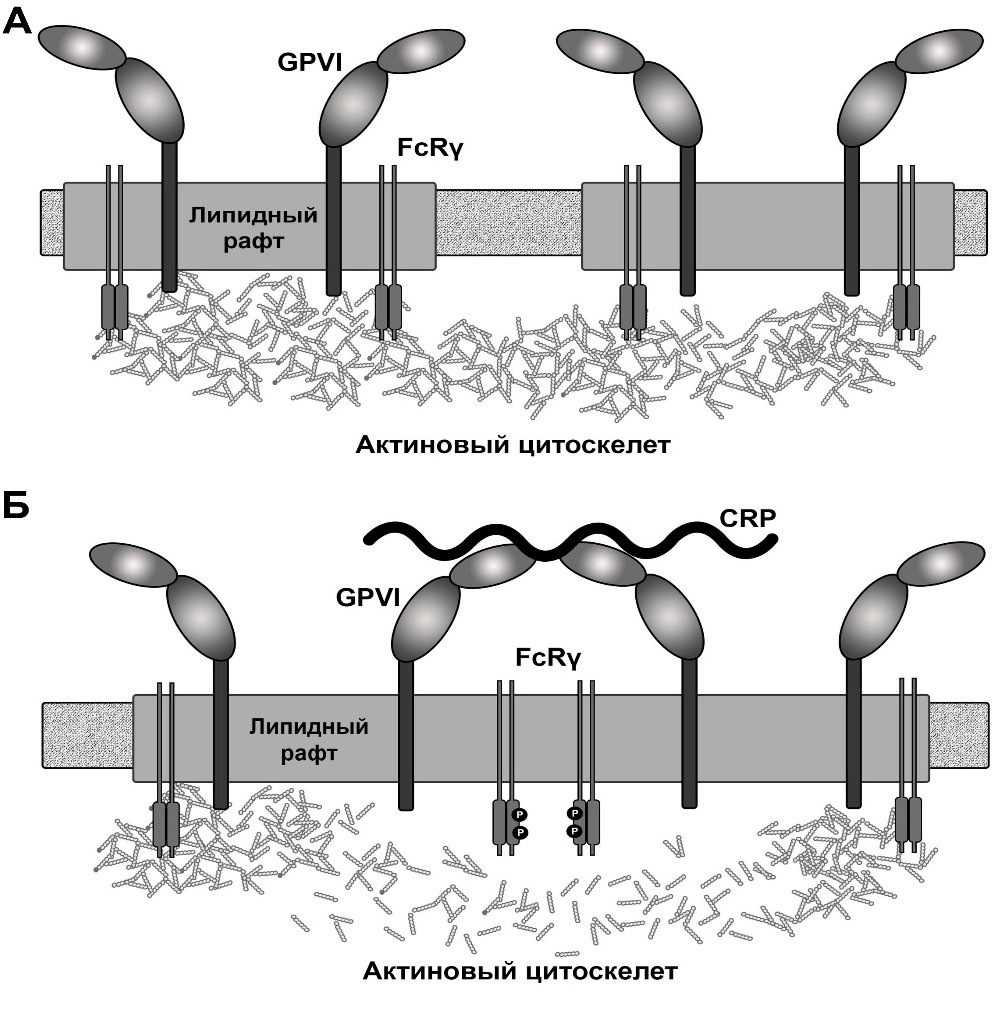
Рисунок 1. Схема модели состояния мембраны тромбоцита в покое (А) и при активации (Б). В покоящемся состоянии диффузия отдельных рецепторов GPVI ограничена плотной сетью актинового цитооскелета. Молекула активатора (в данном случае, CRP) индуцирует физическое стягивание отдельных рецепторов друг к другу. При кластеризации GPVI может перейти в активированное состояние (то есть происходит фосфорилирование ITAM-мотивов, сопряженных с FcRγ-цепями рецепторов). Активация рецептора запускает цепь событий, в результате которых происходит изменение микроокружения (в том числе, изменяется липидный состав мембраны, окружающей рецептор). Данный процесс инициирует локальную деполимеризацию актинового цитоскелета, что вызывает увеличение коэффициента диффузии GPVI.
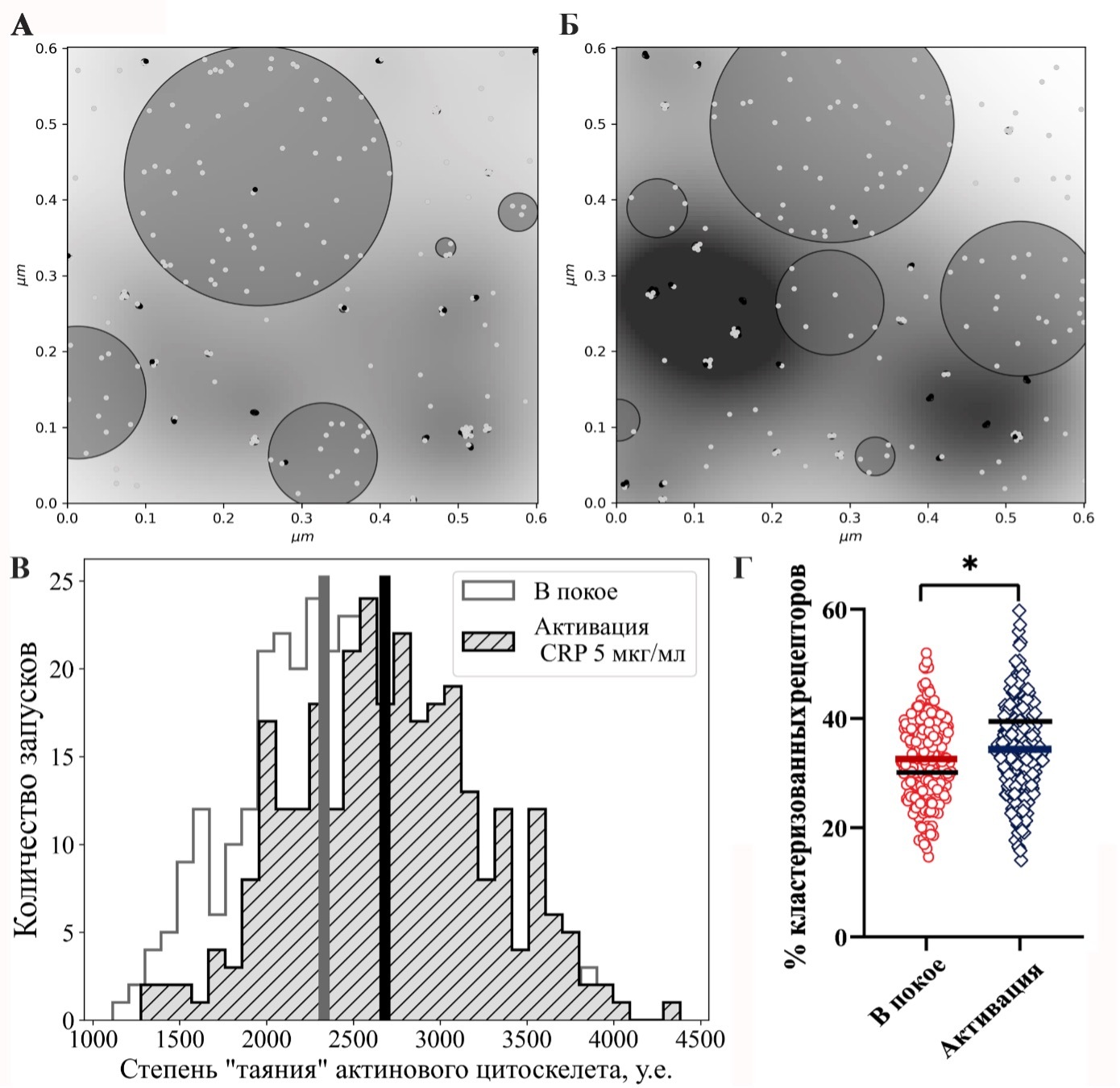
Рисунок 2. Результат работы модели в условиях покоя и активации. Типичное состояние мембраны в покоящемся состоянии (А) и в результате активации 5 мкг/мл CRP (Б). Рецепторы в неактивированном состоянии обозначены светло-серыми точками, активированном – черными. Липидные рафты представлены в виде серых круглых областей с выделенной границей. Области с высоким значением коэффициента μ (и низкой плотностью цитоскелета, соответственно), представлены в виде темных участков на мембране. Области, где коэффициент μ минимален (а плотность цитоскелета максимальна) представлены белым цветом. Чем больше коэффициент μ в определенной точке, тем темнее данная точка. (В) Распределение степени «таяния» актинового цитоскелета на моделируемом участке мембраны на 100 с после запуска для покоящегося состояния (обозначено серым контуром) и при активации 5 мкг/мл CRP (обозначено серым цветом с черными штриховыми линиями). Общее количество запусков для каждого из моделируемых условий – 240. Вертикальные серая и черная линии обозначают средние значения степени «таяния» в состоянии покоя и при активации соответственно. (Г) Сравнение предсказаний модели и экспериментальных данных [55] доли кластеризованных рецепторов в покое (результат отдельного запуска представлен красным кольцом, среднее значение по всем запускам обозначено красной горизонтальной чертой) и при активации 5 мкг/мл CRP (результат отдельного запуска представлен синим ромбом, среднее значение по всем запускам обозначено синей горизонтальной чертой) через 100 с после запуска. Экспериментальные данные представлены черными горизонтальными чертами для разных экспериментальных условий. Общее количество запусков для каждого из моделируемых условий – 240. Оценка статистической значимости производилась по t-критерию Стьюдента (* соответствуют p-value <0.05).
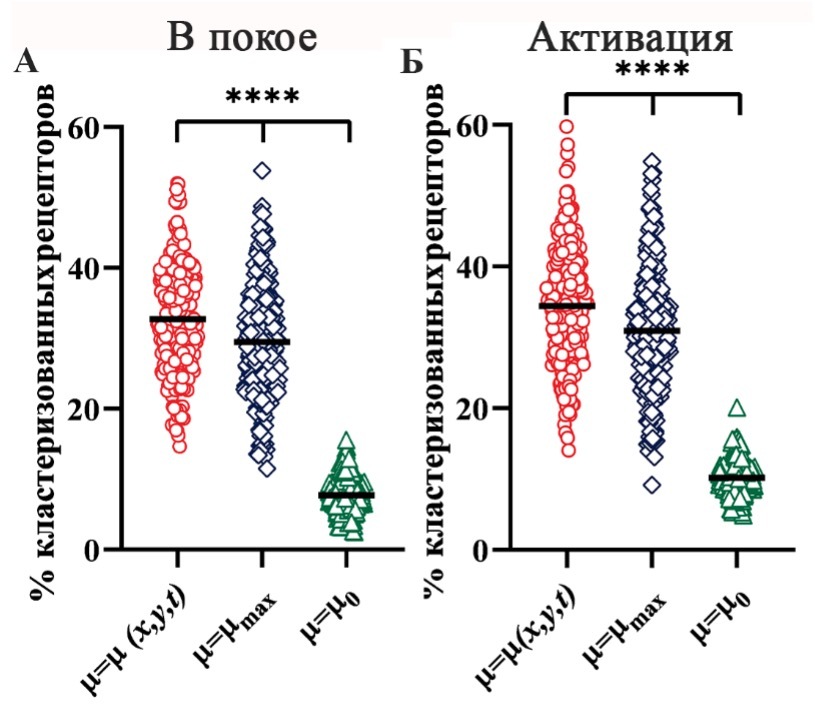
Рисунок 3. Оценка роли «таяния» цитоскелета для поддержания состояния покоя и в процессе активации 5 мкг/мл CRP. Доля кластеризованных рецепторов в состоянии покоя (А) и при активации (Б) при следующих условиях: коэффициент μ зависит от координаты, времени и описывается формулой (4) (результат отдельного запуска представлен красным кольцом); влияние цитоскелета на диффузию отдельных рецепторов минимально- коэффициент μ достигает максимального значения μ=μmax (результат отдельного запуска представлен синим ромбом); «таяние» цитоскелета отсутствует - коэффициент μ не превышает минимального значения μ=μ0 (результат отдельного запуска представлен зеленым треугольником). Общее количество запусков для каждого из моделируемых условий – 240. Результат рассматривался на 100 с после запуска модели. Оценка статистической значимости производилась по критерию Краскела-Уоллиса (**** соответствуют p-value <0.0001).
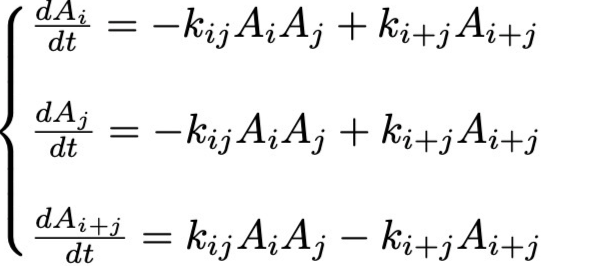
Система ОДУ
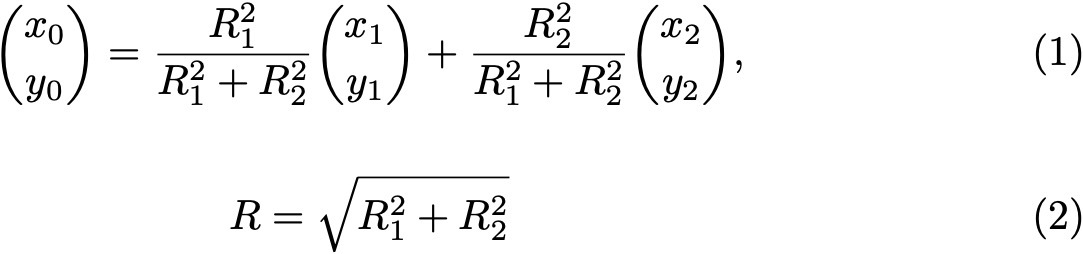
Формулы 1 и 2.
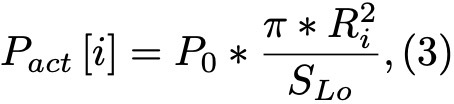
Формула 3.
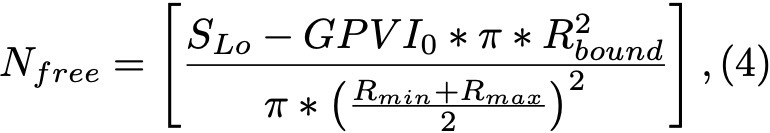
Формула 4.
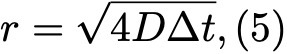
Формула 5.
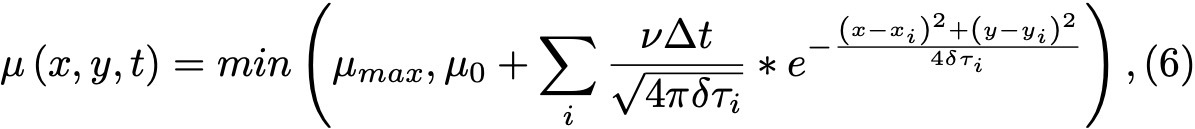
Формула 6.
”Системная биология и физиология”: два года развития
О IV международной конференции “Системная биология и системная физиология - 2023. Цитоскелет”.
Моделирование биополимеров методом броуновской динамики

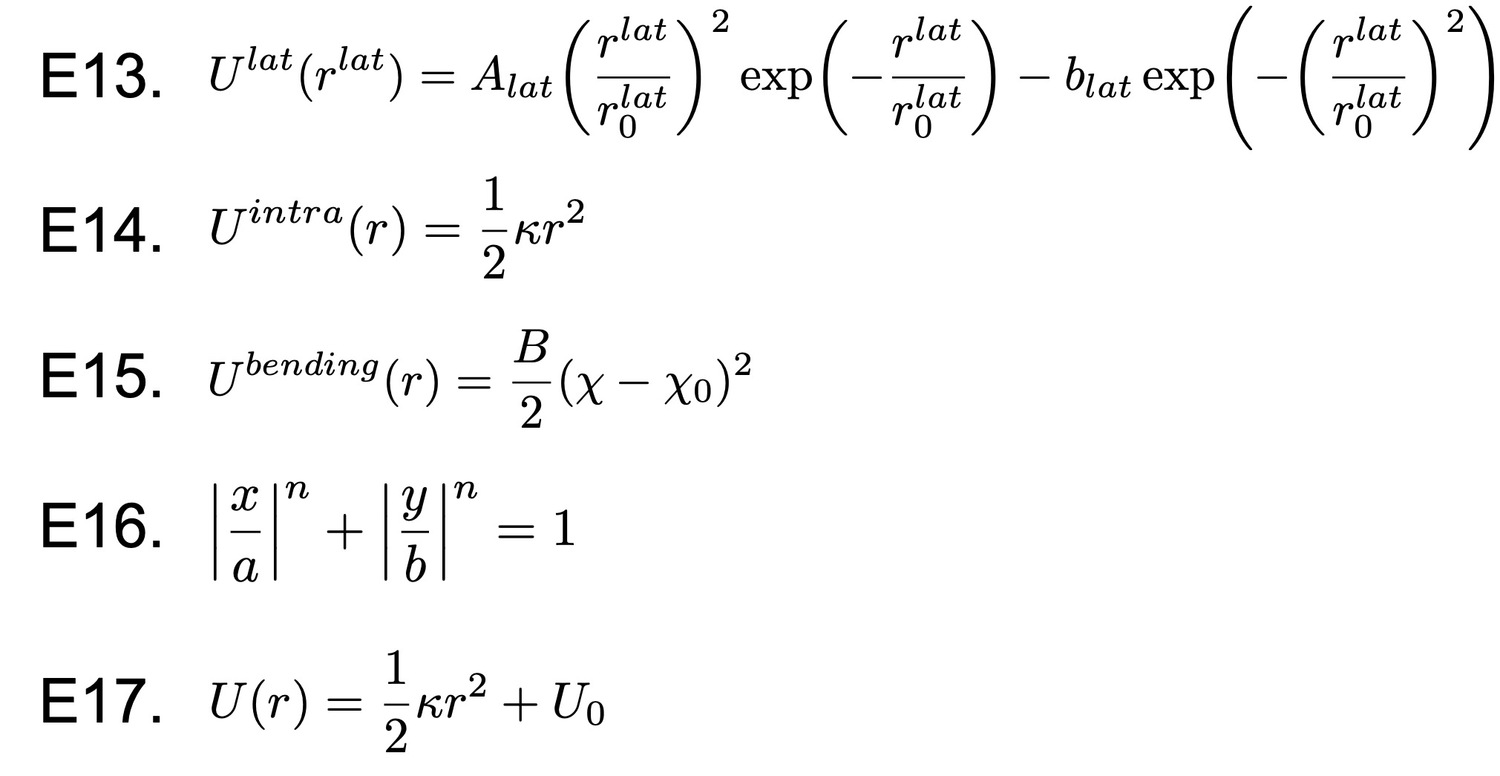
Формулы и выражения, использованные в статье.
Влияние поперечно сшитых продуктов гиалуроновой кислоты на пролиферацию фибробластов кожи человека в культуре
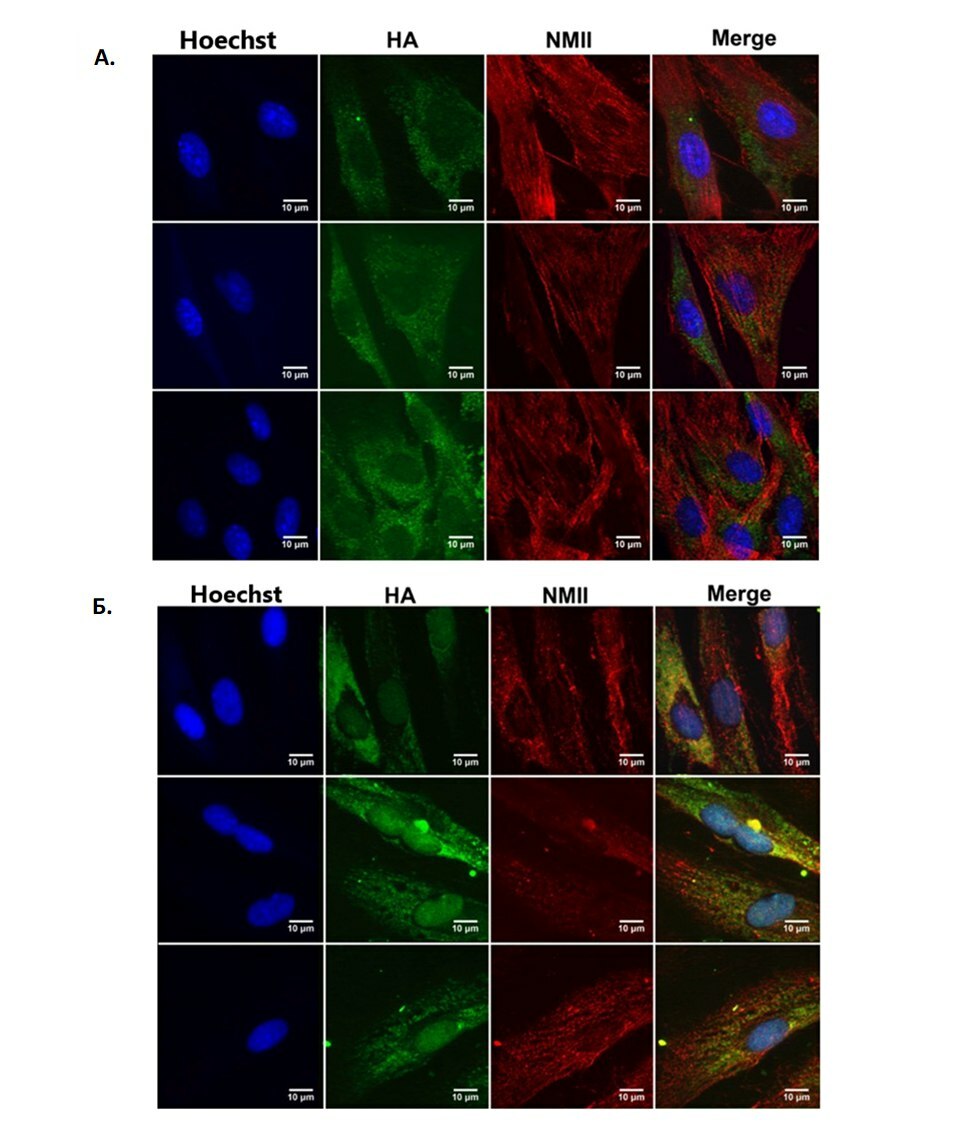
Рисунок 1. Конфокальная микроскопия. Синим Hoechst окрашено ядро, зеленым HA-гиалуроновая кислота, красным NM-миозин, Merge- объединенное. А. Контрольная группа фибробластов. Б. Группа фибробластов, с инкубацией в среде, содержащей 20% (v/v) исследуемого образца ГК (разные поля зрения одного образца).
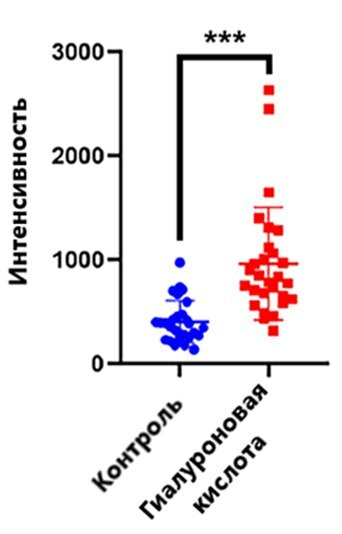
Рисунок 2. Численный анализ флуоресценции гиалурон-связывающего белка в клетках неинкубированных (синий) и проинкубированных (красный) с высокомолекулярной ГК, сшитой ДВС. Статистическая значимость различий оценивалась по критерию Манна-Уитни (*** соответствуют p-value <0.001).
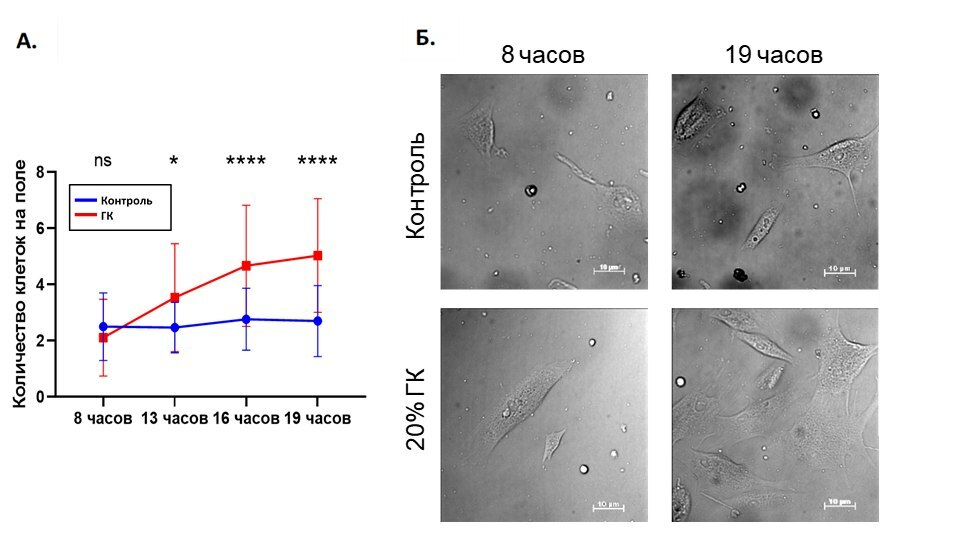
Рисунок 3. Наблюдение пролиферации фибробластов человека в присутствии ГК. (А) График зависимости среднего количества фибробластов от времени. Синим обозначен контрольный образец, красным – образец, инкубируемый в присутствии исследуемого геля ГК. Сколько полей зрения было проанализировано для каждого времени инкубации? Статистическая значимость различий оценивалась по критерию Манна-Уитни при n = 10 (* соответствуют p-value <0.05, *** соответствуют p-value <0.001). (Б) Приведены типичные фотографии фибробластов кожи человека: контрольный образец через 8 часов и 19 часов после начала инкубации. И образец, инкубируемый с 20% высокомолекулярной ГК, сшитой ДВС, через 8 часов и 19 часов после начала инкубации.
Реологические условия в системе кровоснабжения мозга при ишемическом инсульте
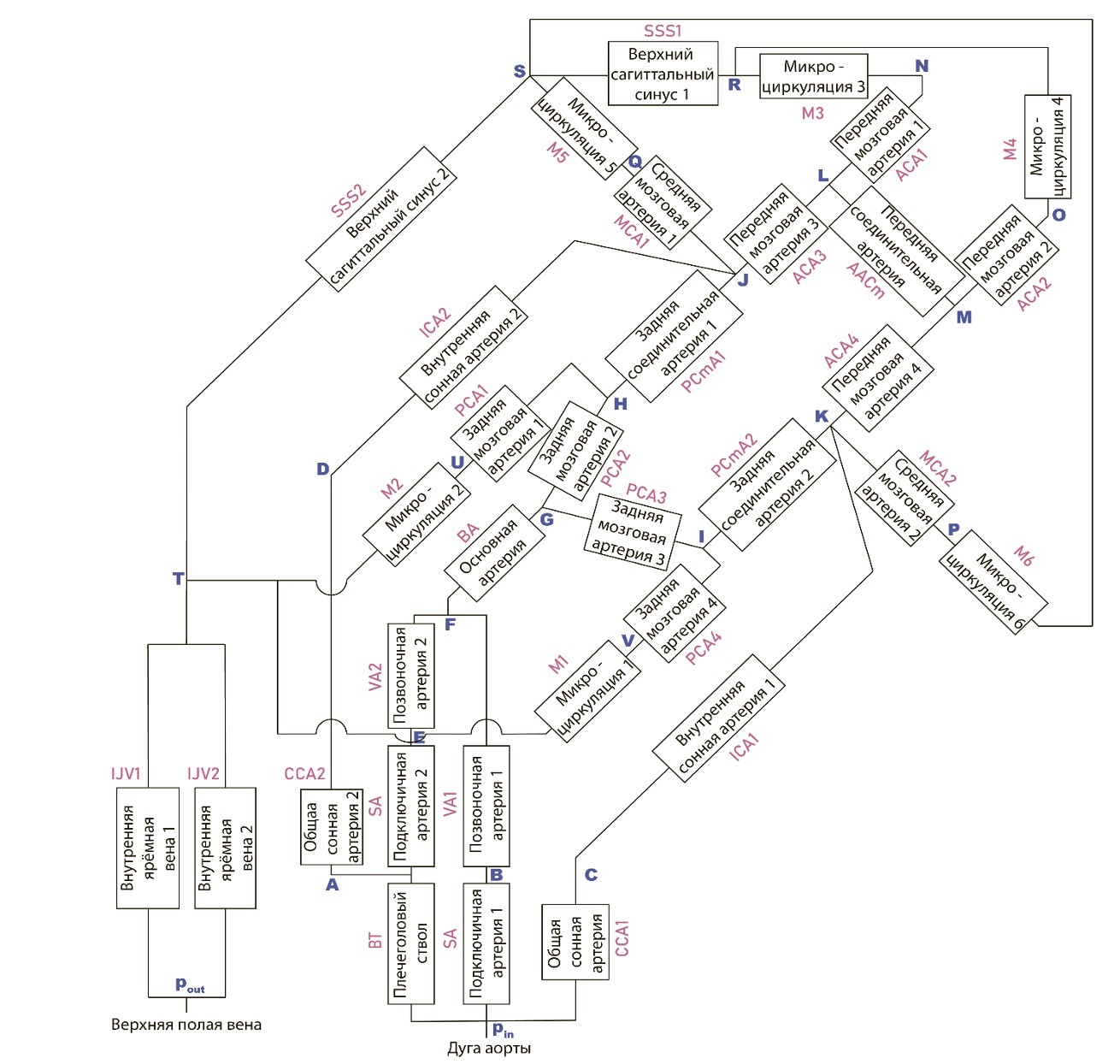
Рисунок 1. Схема модели кровоснабжения мозга. Прямоугольниками обозначены сосуды системы. Названия сосудов написаны внутри прямоугольников. Вычисляется проходящий через них объёмный расход крови. Синими буквами обозначены узлы системы. В них вычисляются давления. Красным шрифтом написаны аббревиатуры сосудов.
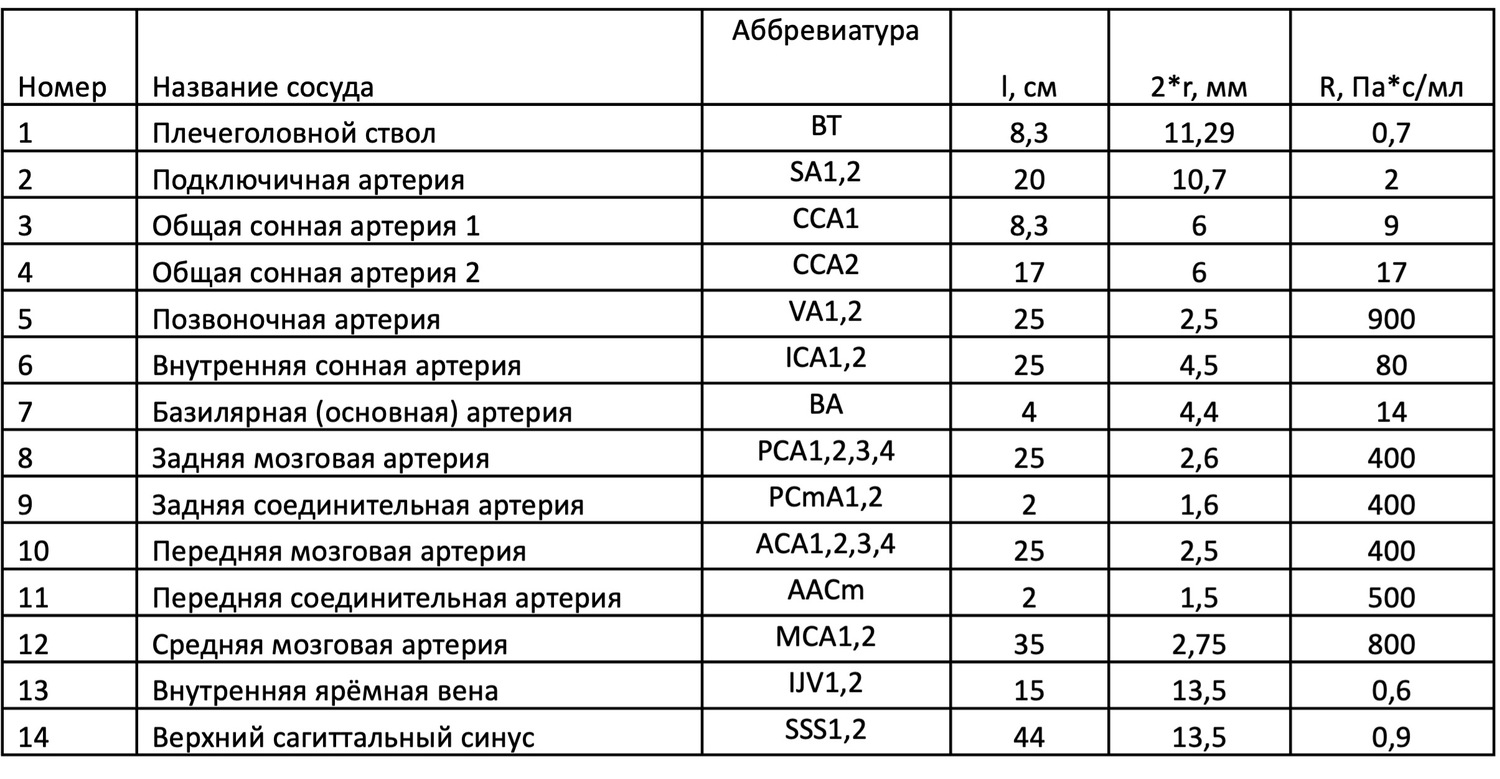
Таблица 1. Размеры и сопротивления сосудов модели. * BT - Brachiocephalic Trunk – плечеголовной ствол, SA1,2 – Subclavian Artery - Подключичная артерия, VA1,2 - Vertebral Artery - Позвоночная артерия, CCA1,2 - Common Carotid Artery - Общая сонная артерия, ICA1,2 - Internal Carotid Artery - Внутренняя сонная артерия, BA - Basilar Artery - Базилярная (основная) артерия, PCA1,2,3,4 - Posterior Cerebral Artery - Задняя мозговая артерия, PCmA1,2 - Posterior Communicating Artery - Задняя соединительная артерия, ACA1,2,3,4 - Anterior Cerebral Artery - Передняя мозговая артерия, AACm - Anterior Communicating Artery - Передняя соединительная артерия, MCA1,2 - Middle Cerebral Artery - Средняя мозговая артерия, IJV1,2 - Internal Jugular Vein - Внутренняя ярёмная вена, SSS1,2 - Superior Sagittal Sinus - Верхний сагиттальный синус.
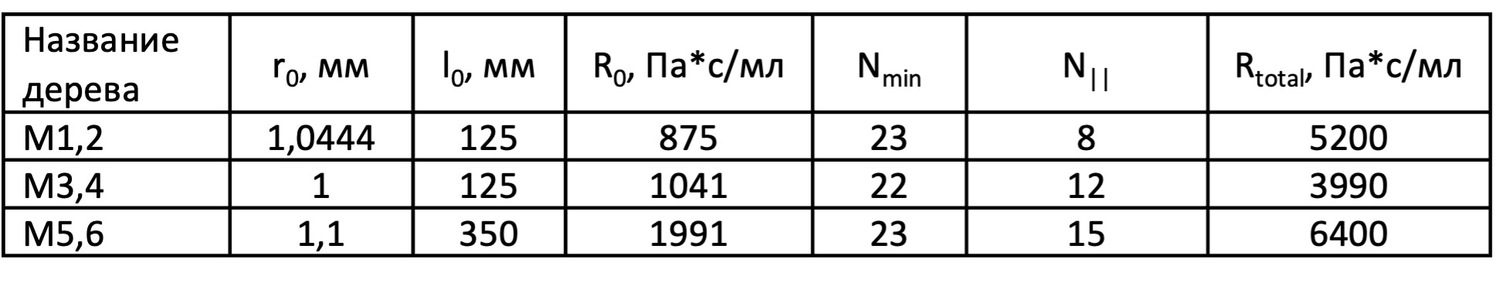
Таблица 2. Параметры микроциркуляторных деревьев.
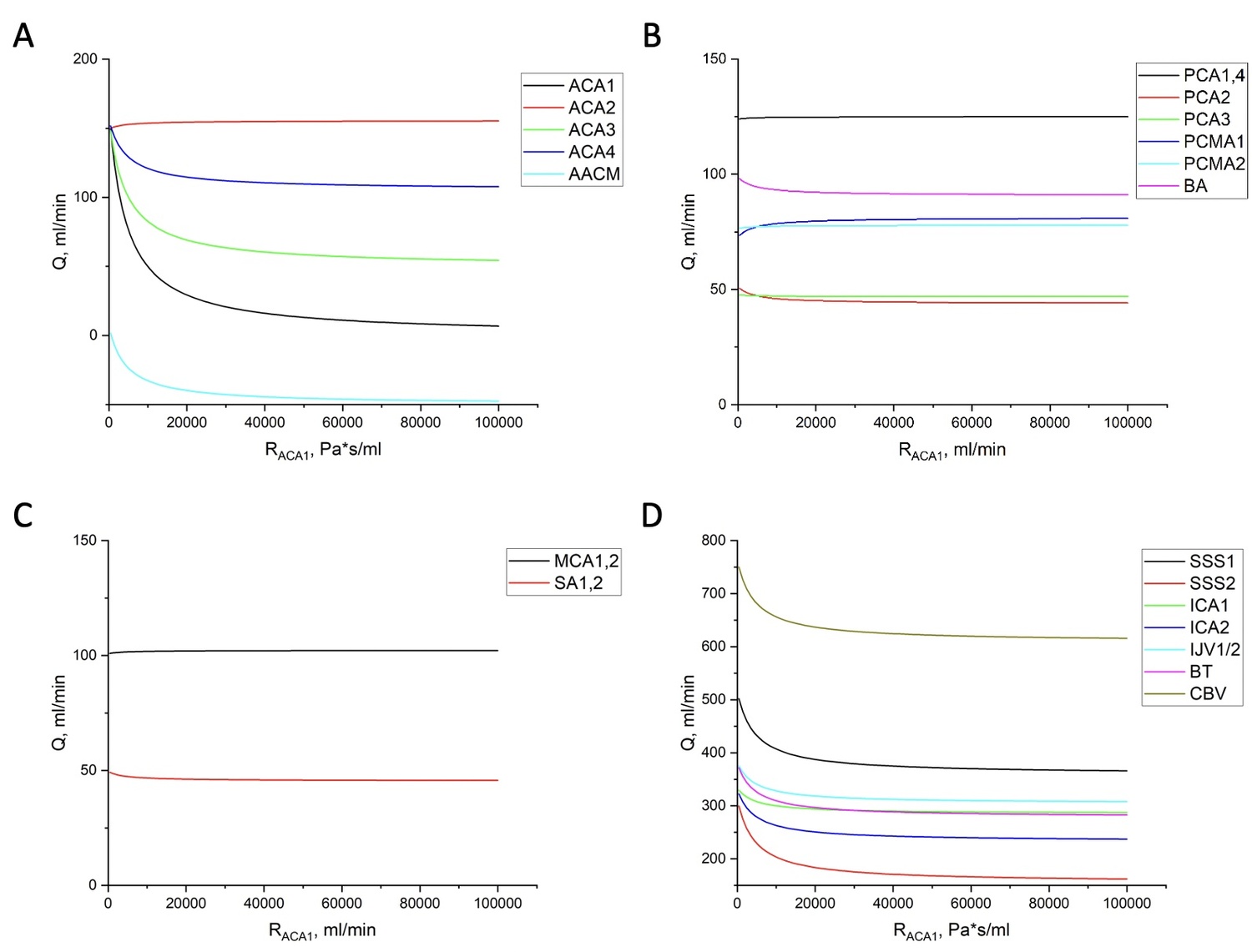
Рисунок 2. Распределение объёмных расходов крови в системе сосудов мозга при увеличении сопротивления (окклюзии) ACA1 в бассейне:
A: переднемозговых артерий
B: заднемозговых артерий и основной артрии (BA)
C: среднемозговых артерий и подключичных артерий (SA1,2)
D: рассматриваемых вен, венозных синусов, некоторых артерий и общий объём крови, прокачиваемый через мозг Cerebral Blood Volume (CBV).
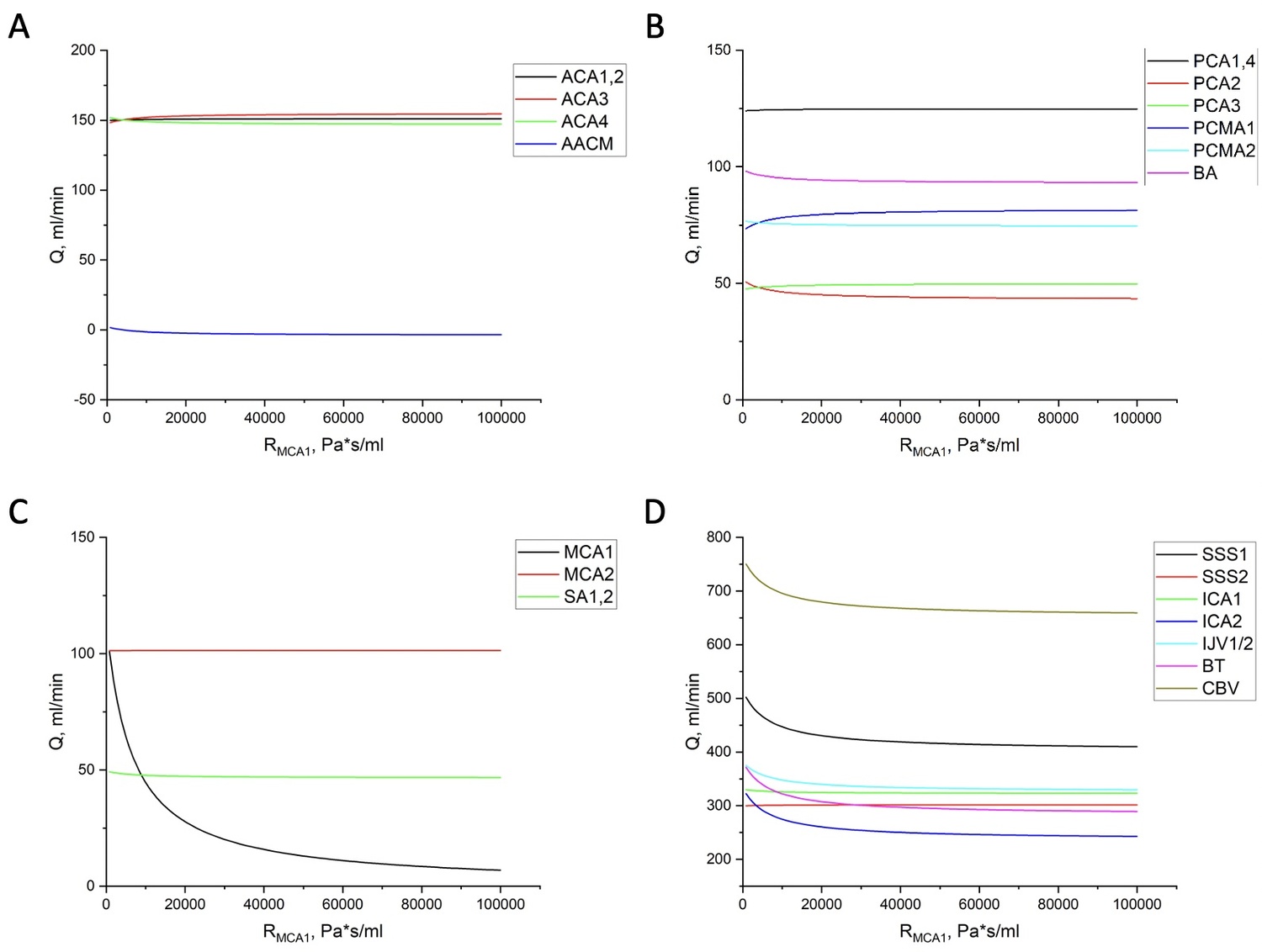
Рисунок 3. Распределение объёмных расходов крови в системе сосудов мозга при увеличении сопротивления (окклюзии) MCA1 в бассейне:
A: переднемозговых артерий
B: заднемозговых артерий и основной артрии (BA)
C: среднемозговых артерий и подключичных артерий (SA1,2)
D: рассматриваемых вен, венозных синусов, некоторых артерий и CBV.
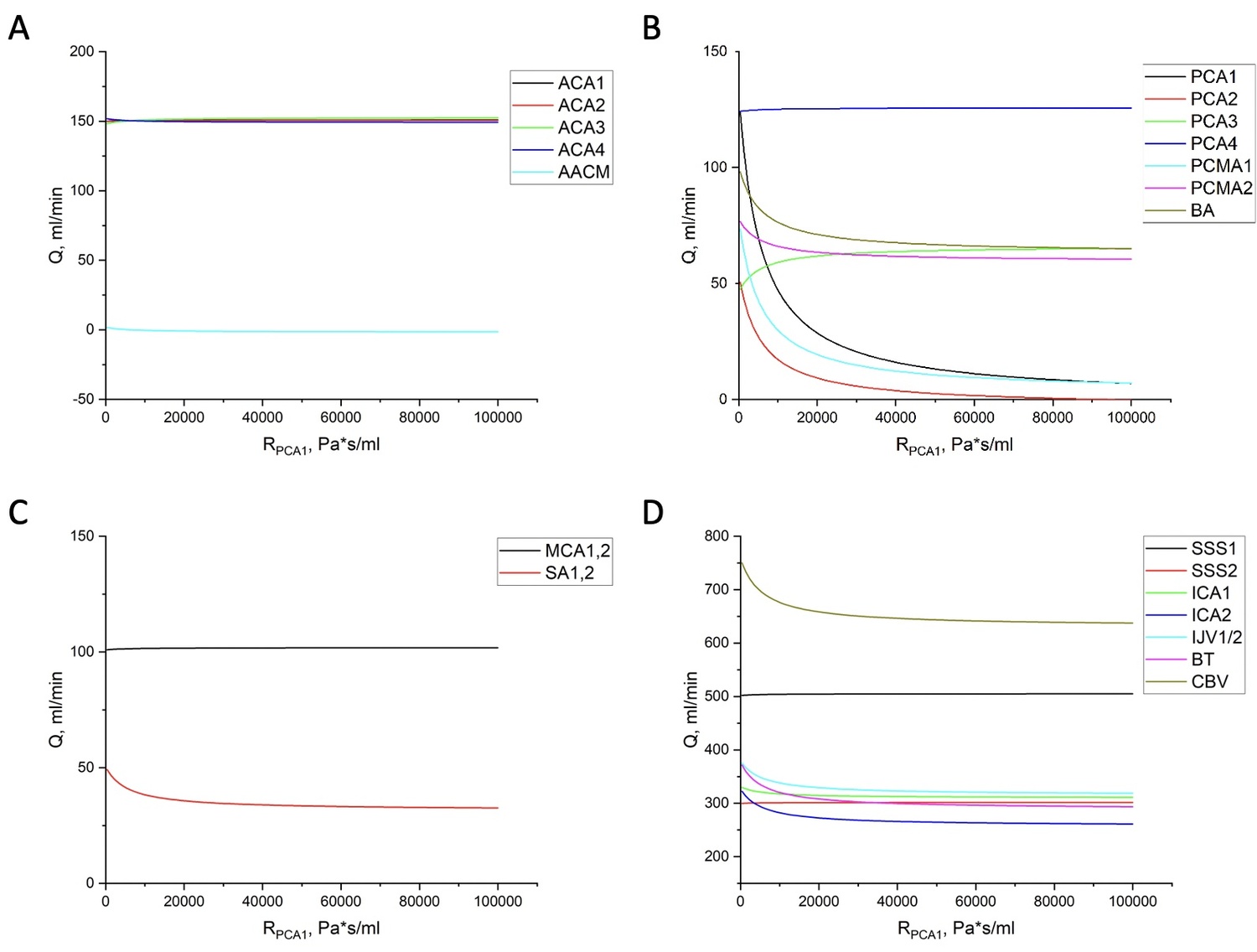
Рисунок 4. Распределение объёмных расходов крови в системе сосудов мозга при увеличении сопротивления (окклюзии) PCA1 в бассейне:
A: переднемозговых артерий
B: заднемозговых артерий и основной артрии (BA)
C: среднемозговых артерий и подключичных артерий (SA1,2)
D: рассматриваемых вен, венозных синусов, некоторых артерий и CBV.
Биомаркеры пульпита: системный анализ молекулярной патофизиологии
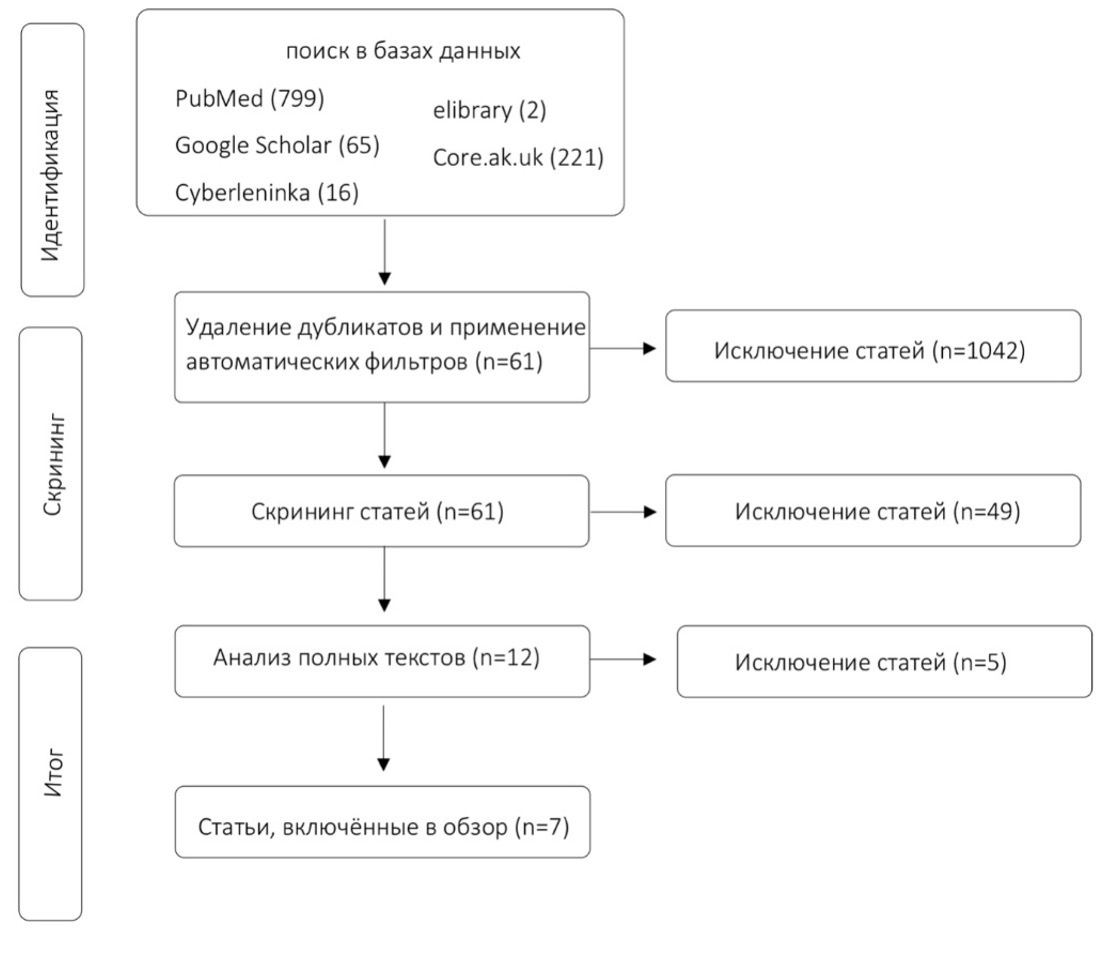
Рисунок 1. Диаграмма этапов поиска литературы.
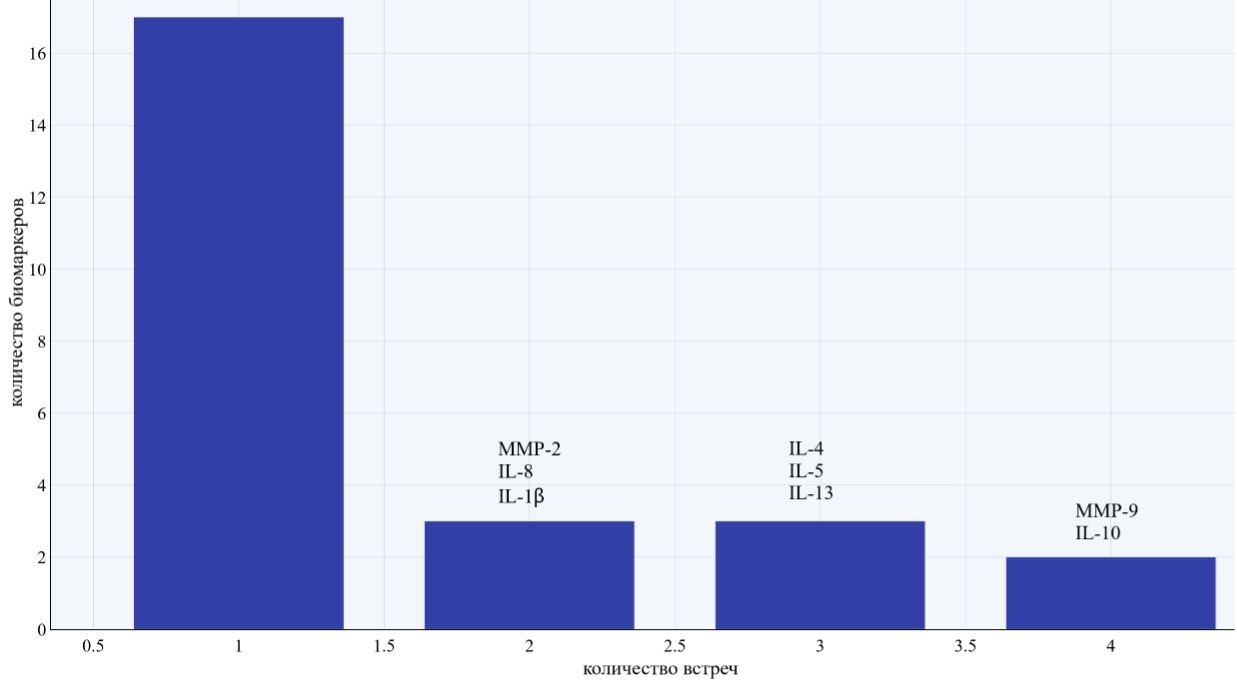
Рисунок 2. Иллюстрировано распределение биомаркеров по встречаемости в анализируемых исследованиях.
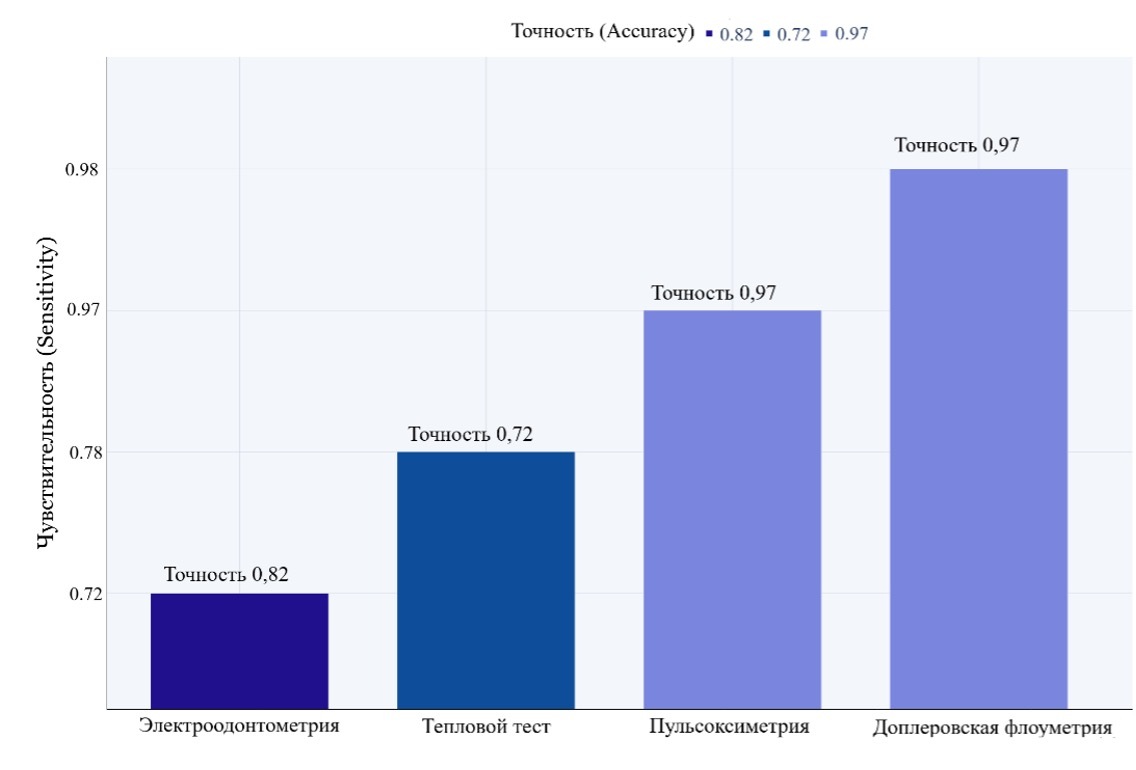
Рисунок 3. Демонстрация чувствительности, точности различных методов диагностики при лечении пульпита.
Таблица 1. Таблица экстракции данных.
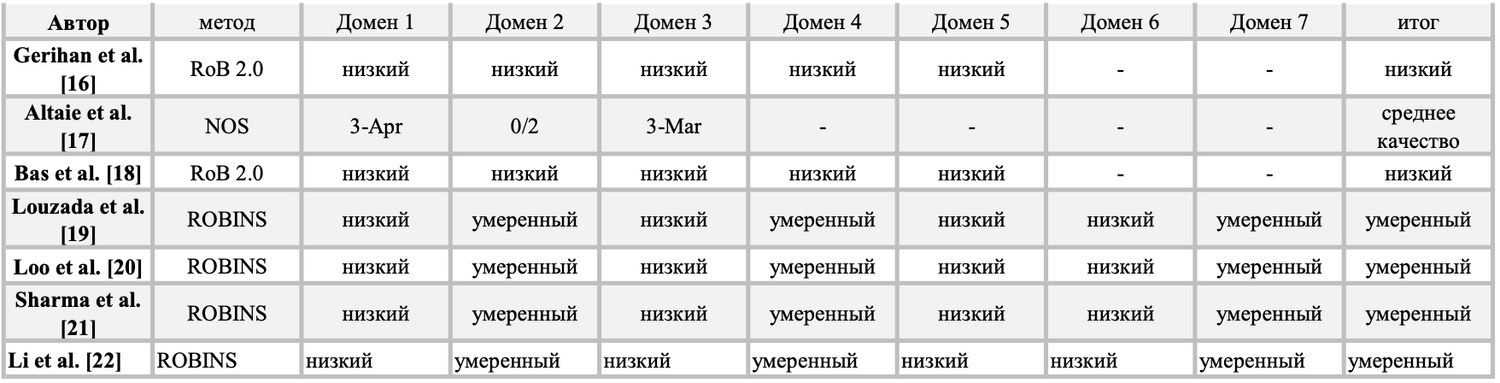
Таблица 2. Результаты анализа на риск статистической предвзятости.
Снижение витальности опухолевых клеток ведет к усилению их тромбогенных свойств
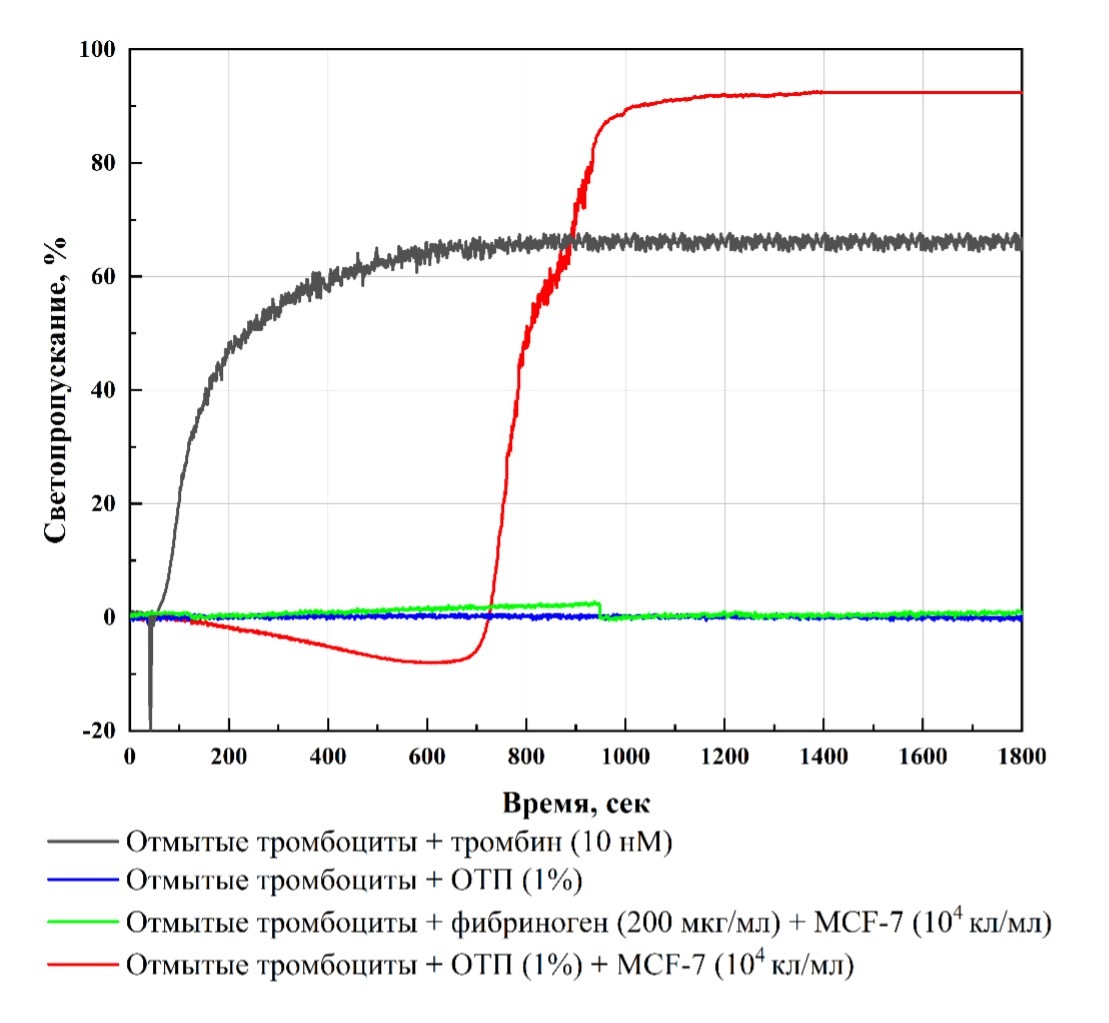
Рисунок 1. Агрегация отмытых тромбоцитов в ответ на добавление различных активаторов [6].
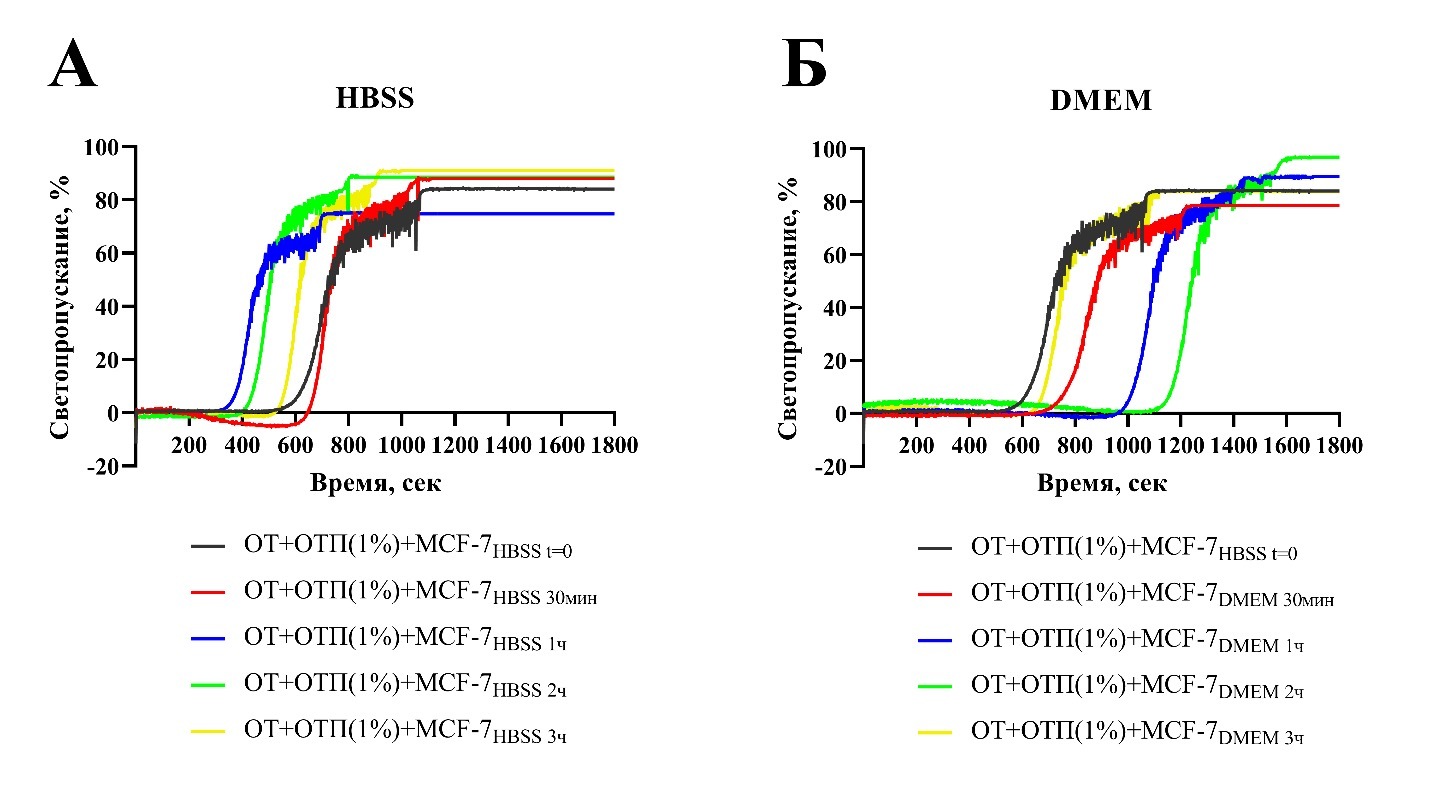
Рисунок 2. Типичные кривые агрегации суспензии отмытых тромбоцитов (ОТ) в присутствии кальция и 1% обедненной тромбоцитами плазмы (ОТП) при добавлении опухолевых клеток линии MCF-7, инкубировавшихся в HBSS (А) или в питательной среде DMEM (Б).
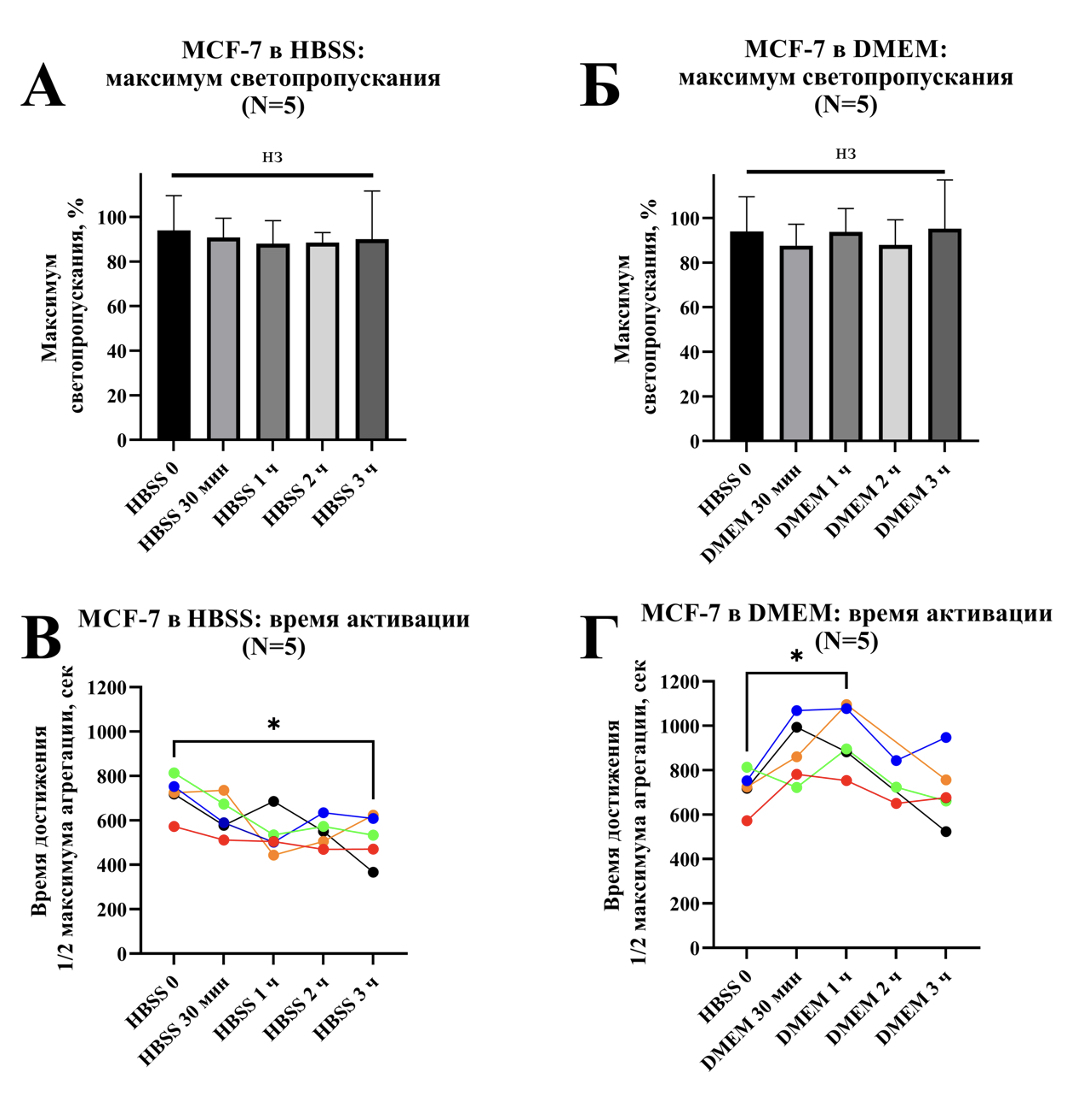
Рисунок 3. Агрегация суспензии отмытых тромбоцитов (ОТ) в присутствии кальция и 1% обедненной тромбоцитами плазмы (ОТП) при добавлении опухолевых клеток линии MCF-7, инкубировавшихся в HBSS или в питательной среде DMEM (n=5). А, Б – максимальное светопропускание, В, Г – время достижения 1/2 максимума агрегации. * – p < 0.05
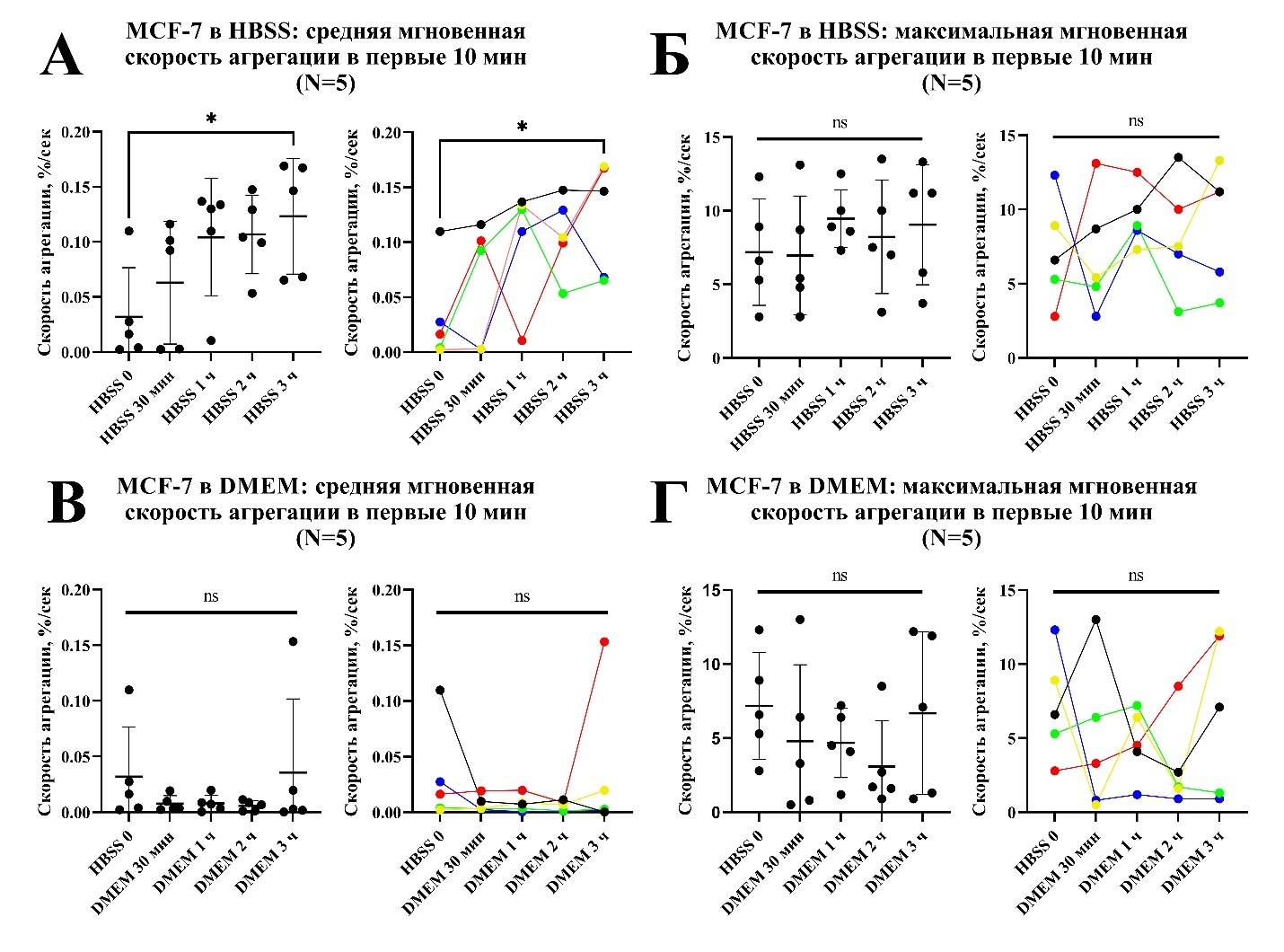
Рисунок 4. Агрегация суспензии отмытых тромбоцитов (ОТ) в присутствии кальция и 1% обедненной тромбоцитами плазмы (ОТП) при добавлении опухолевых клеток линии MCF-7, инкубировавшихся в HBSS или в питательной среде DMEM (n=5). А, В – средняя мгновенная скорость агрегации в первые 10 мин постановки, Б, Г – максимальная мгновенная скорость агрегации в первые 10 мин постановки. * – p < 0.05
Флуориметрические методы анализа взаимодействий между молекулами
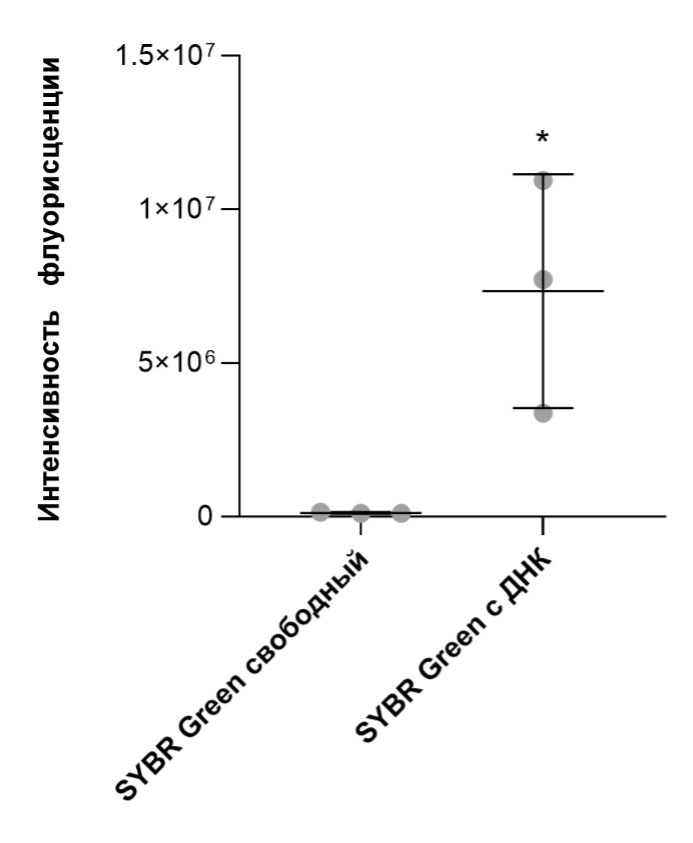
Рисунок 1. Интенсивность SYBR Green в свободном состоянии и при добавлении ДНК. Данные представлены как среднее ± стандартное отклонение по N=3 независимым экспериментам.
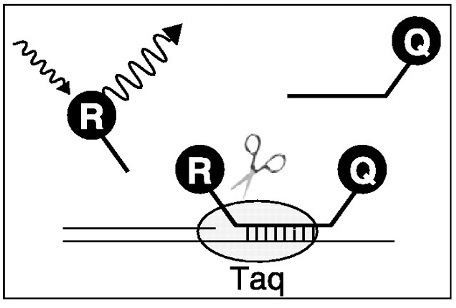
Рисунок 2. Механизм действия Taqman зонда. ДРепортерный флуорофор (R), испускает свет на длине олны, поглощаемой гасящим флуорофором (Q). Во время ПЦР-амплификации ДНК-полимераза (Taq) расщепляет зонд, высвобождая репортёр от гасителя, что позволяет измерить флуоресценцию. Иллюстрация воспроизведена из статьи [8] по лицензии Creative Commons Attribution 4.0.
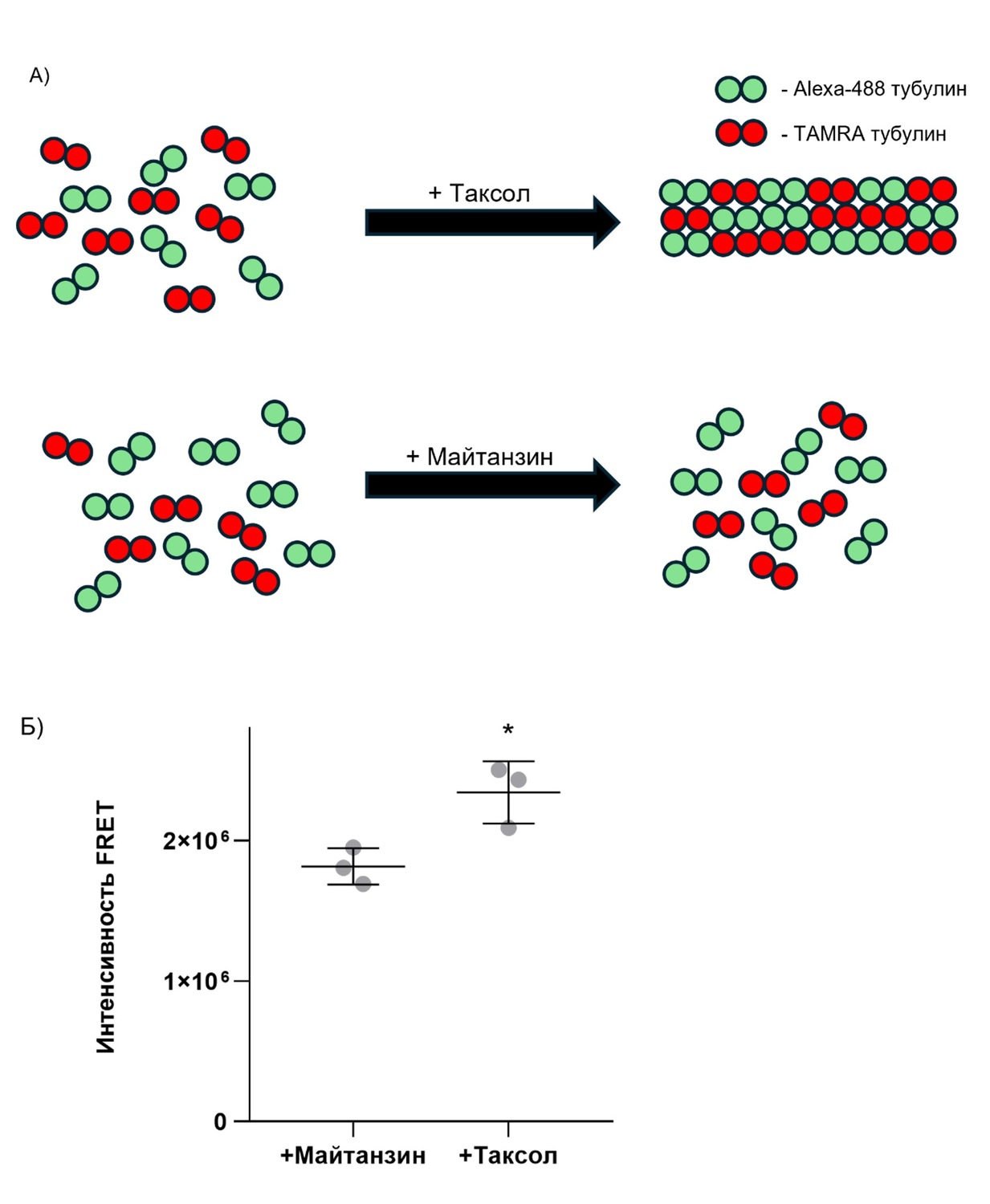
Рисунок 3. FRET между димерами тубулина, меченными красителями Alexa-488 и TAMRA при полимеризации микротрубочек. А) Постановка эксперимента по полимеризации микротрубочек в присутствии таксола и майтанзина. При добавлении таксола полимеризация тубулиновых микротрубочек происходит нормально, а при добавлении майтанзина полимеризации не происходит. Б) Интенсивность FRET в двух условиях. Данные представлены как среднее ± стандартное отклонение по N=3 независимым экспериментам.
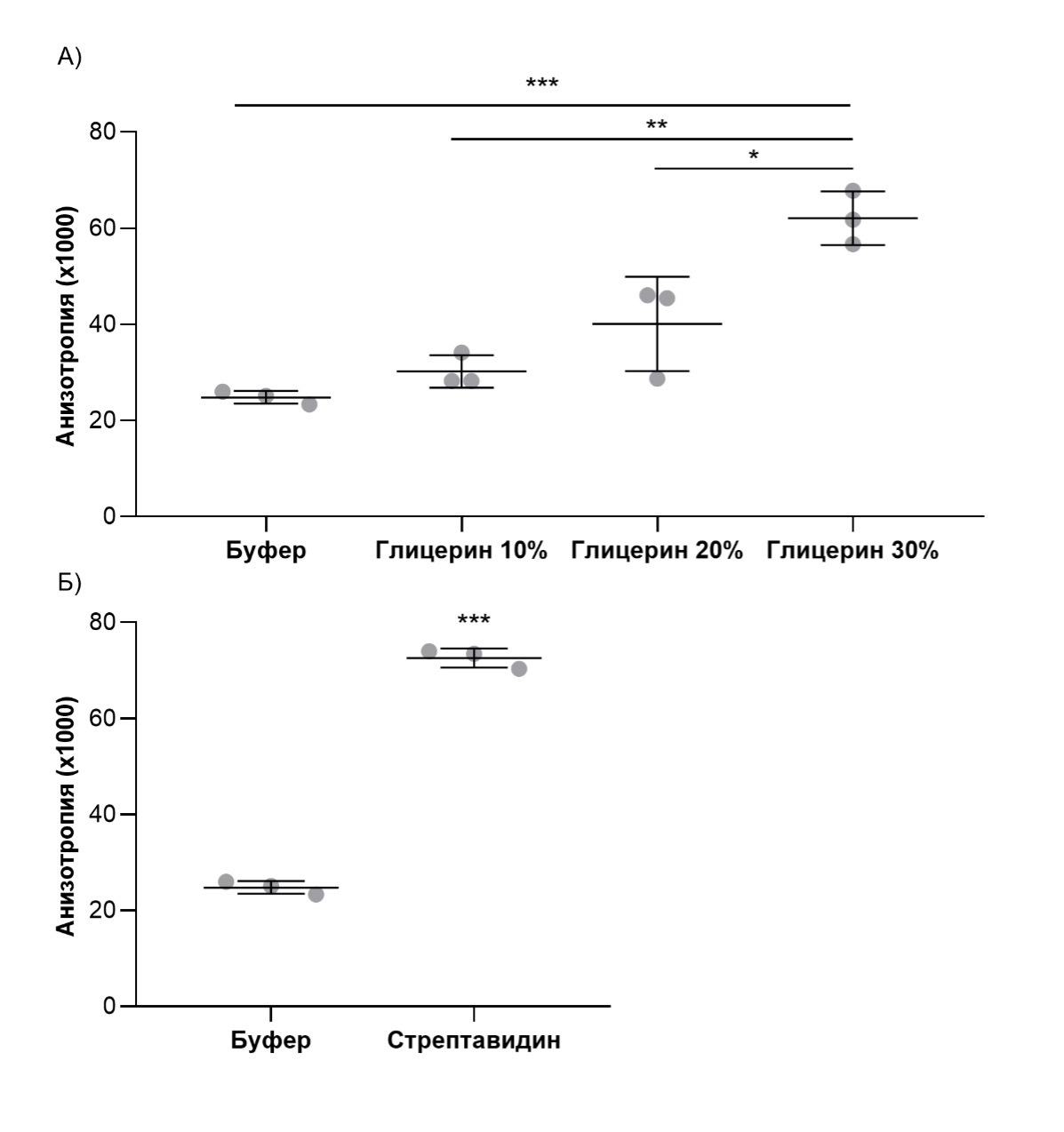
Рисунок 4. Изменение анизотропии флуорисценции. Постановка эксперимента по полимеризации микротрубочеА) Увеличение анизотропии FITC с увеличением вязкости раствора. Б) Увеличение анизотропии комплекса стрептавидин-биотин-FITC. Данные представлены как среднее ± стандартное отклонение по N=3 независимым экспериментам.
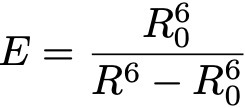
Формула 1.
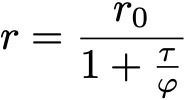
Формула 2.
Роль тромбоцитарных микроРНК при раке молочной железы
Основные подходы в конструировании микрофлюидных камер для анализа системы гемостаза
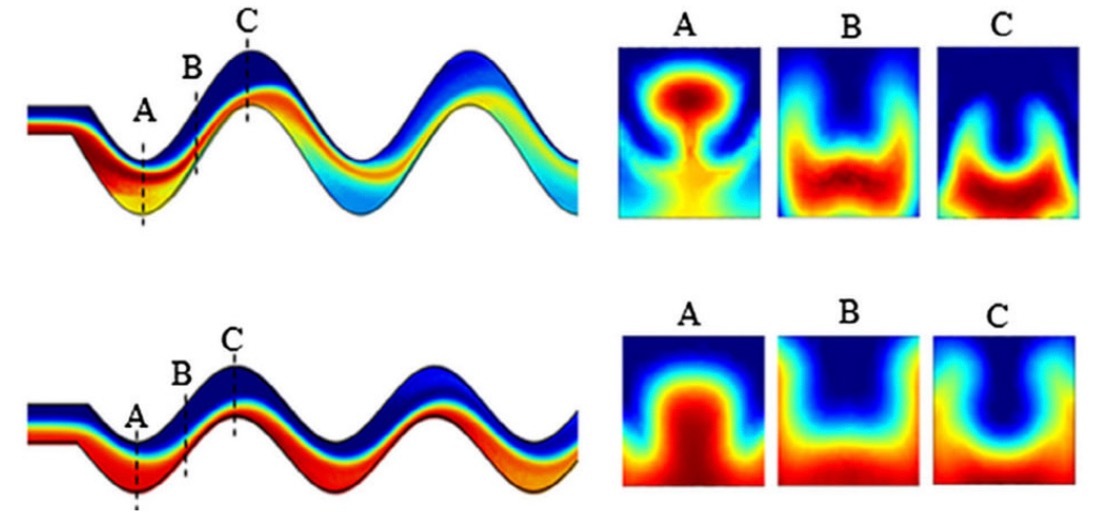
Рисунок 1. Пример распределения концентрации жидкости в S-образном микроканале в различных точках потока(A,B,C).Прохождение жидкости через изгибы способствует лучшему смешиванию в условиях ламинарного течения [1].
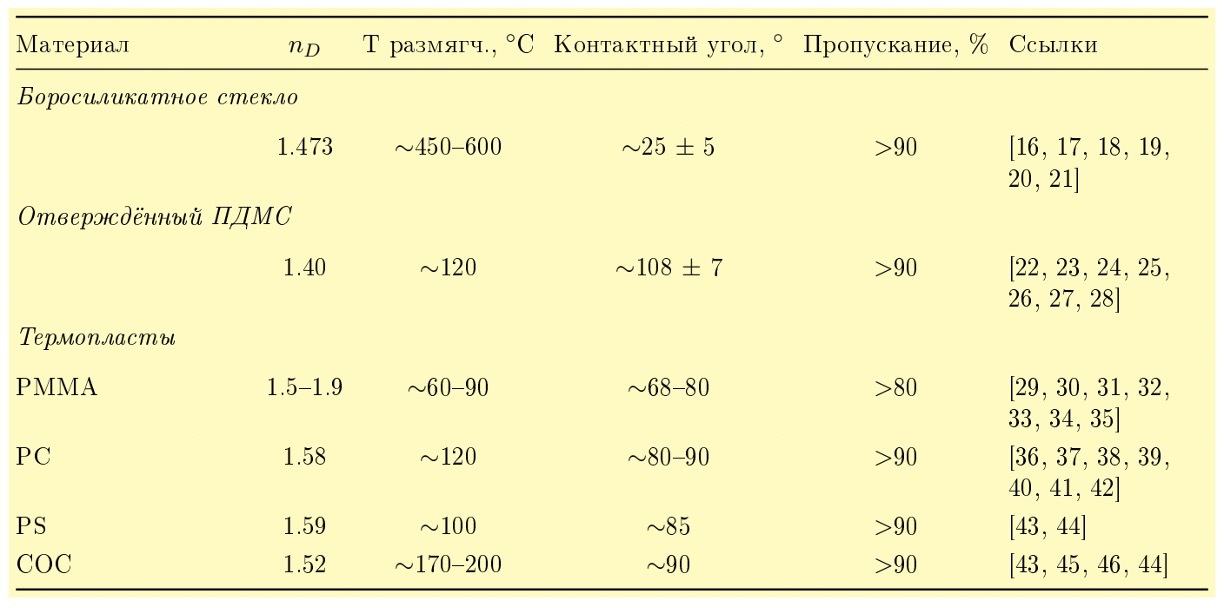
Таблица 1. Типичные оптические и физические свойства материалов для микрофлюидики.

Таблица 2. Методы связи и иммобилизации биомолекул в микрофлюидных устройствах.

Текстовый блок
На странице "О нас" можно разместить описание своего опыта работы, как важно и дорого вам то, чем вы знимаетесь. С кем вы сотрудничаете, каких успехов добились.
Написать немного о своей команде. О том, какие они профессиональные и преданные своему делу люди. Ну или о себе - если в команде пока только один человек - ВЫ :)Так же тут можно повторить еще раз перечень ключевых товаров и услуг, продублировать акции и спецпредложения.